脳神経回路形成プロジェクト 丸山千秋プロジェクトリーダー及び隈元拓馬主席研究員は、横浜市立大学附属病院遺伝子診療科 宮武聡子講師、同大学大学院医学研究科 遺伝学 松本直通教授、昭和大学医学部小児科学講座 加藤光広教授、横浜市立大学大学院医学研究科 分子生物学教室 廣瀬智威講師、高橋秀尚教授、同生化学教室 濱田恵輔助教、緒方一博教授、同神経内科 竹内英之准教授、田中章景教授を中心とする研究グループとともに、「多小脳回」の新たな原因遺伝子 ATP1A3 を同定しました。ATP1A3 遺伝子は小児交代性片麻痺の原因としてよく知られていますが、本遺伝子異常による新たな疾患が明らかになり、今後、「多小脳回」の病態の解明や治療法の開発に寄与することが期待されます。
本研究成果は、米国科学誌『Science Advances』に掲載されました。(日本時間3月25日午前3時付オンライン)
胎児の脳が形成される段階で何らかの異常が生じて、大脳の表面に近い部分にある大脳皮質と呼ばれる場所が正しい形に作られない疾患を「大脳皮質形成異常症」と総称し、病的に小さい脳回(脳の表面のしわの隆起部分)が多発する「多小脳回」はその中でも比較的頻度が高い病型です。脳の形態は正常とは異なり、小さい脳回が多数できて、それらが不規則に融合した結果、いろいろな大脳皮質の形態異常を呈し、臨床的には、てんかん、知的障害、構音障害(うまく発音できない)、嚥下障害(上手に飲みこめない)など様々な神経症状が出現します。大脳皮質の形成過程では、神経細胞が脳の中を移動して、本来あるべき場所に位置します。うまく移動できなかったり、移動し終わった後の様々な形成過程の障害があるとこの疾患が生じると考えられていますが、その病態はよくわかっていません。
胎児期のある種の感染症や低酸素症などでも起こりますが、遺伝学的な原因として、細胞の骨格や移動に関わるチュブリンという分子に関連した遺伝子群をはじめ、いくつかの遺伝子が知られています。まだ明らかになっていないものも多数あると考えられているため、本研究は「多小脳回」を呈する患者さんのうち、これまで知られている「多小脳回」の原因となる遺伝子に変異を持たない患者さんのサンプルを集めて、網羅的な遺伝子解析を行い、未知の遺伝学的要因を明らかにすることを目的として実施しました。
「多小脳回」を呈する124人の患者さんに対して全エクソーム解析を行い、8人でATP1A3 遺伝子の突然変異を検出しました(検出率6.5%)。ATP1A3 遺伝子は、その変異により小児交代性片麻痺(alternating hemiplegia of childhood:AHC)、急性発症ジストニア・パーキンソニズム(rapid-onset dystonia parkinsonism: RDP)、小脳失調症・深部腱反射消失・凹足・視神経萎縮・感覚神経障害性聴覚障害(cerebellar ataxia, areflexia, pes cavus, optic atrophy, and sensorineural hearing loss:CAPOS)が起こることがよく知られている遺伝子です。これらの3つの疾患は、それぞれに特有の症状が知られていますが互いの症状にオーバーラップも見られるため、最近では、病態的な観点から1つのまとまった疾患ではないかと考えられています。しかし、今回変異が見つかった8人の患者さんは、AHC, RDP, CAPOSの症状とは合致せず、脳は形態的に異常な「多小脳回」を呈し、臨床的には非常に重篤なてんかん、精神運動発達遅滞、知的障害が認められました。特に重度の患者さんでは、進行性の脳萎縮や心臓の症状も見られるという特徴がありました(図1)。
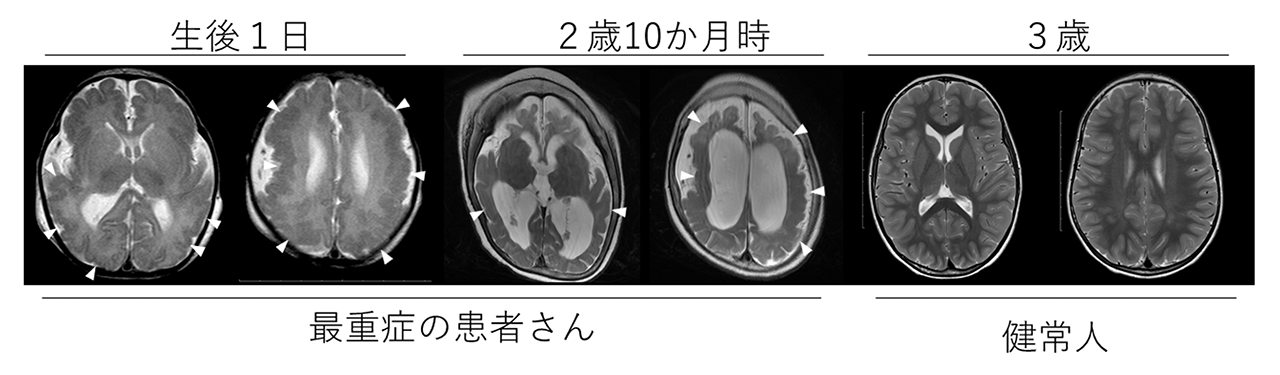
図1. 患者さんで見られた脳大脳皮質形成異常(「多小脳回」)
最重症の1例で、生後1日(左の2つ)、2歳10か月時(真中の2つ)に撮影された頭部MRI画像、および健常人で3歳時に撮影された頭部MRI画像(右の2つ)を示す。患者さんでは、矢頭で示した部位には、不規則で小さい脳回が見られ、大脳皮質が異常に厚くなっており、「多小脳回」と考えられる。生後1日のときに比べ、2歳10か月時では大脳が萎縮している。
今回、見つかった変異について、Na+/K+-ATPase*3のαサブユニットをコードするATP1A3 遺伝子上の遺伝子変異の分布を立体的に調べると、AHC, RDP, CAPOSで報告されている変異の分布と異なり、βサブユニットとの相互作用部位に多くみられました(図2)。
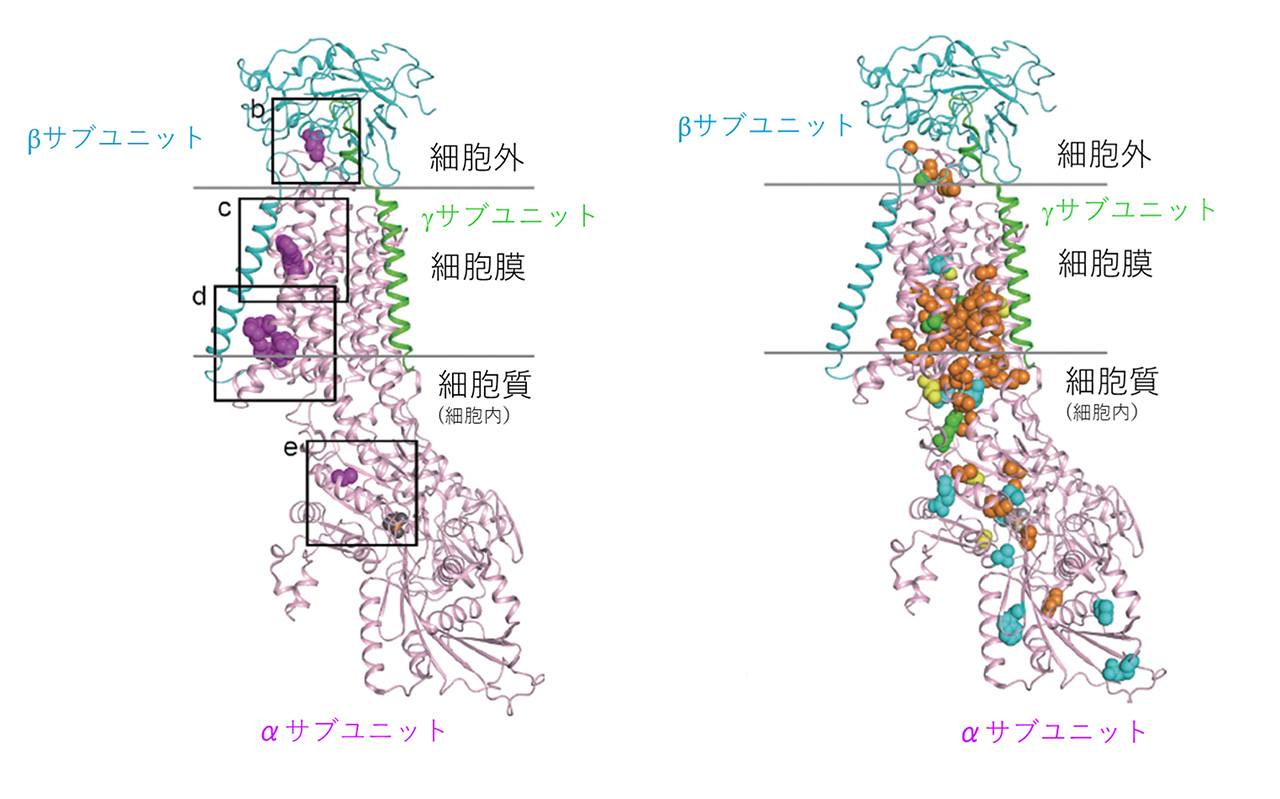
図2. Na+/K+-ATPaseのαサブユニット上における変異の分布
左右の図は、アブラツノザメのNa+/K+-ATPaseの結晶構造解析のデータをもとに作成されたもの。中心に位置するピンク色の大きな構造物がNa+/K+-ATPase αサブユニット、左側~上方に位置する青い構造物がβサブユニット、右側の緑色の小構造物がγサブユニットを表している。左側の図に赤色でプロットした箇所が、今回見つかった「多小脳回」に関連する変異部分である。右側の図に、オレンジ色(AHCに関連する変異)、青色(RDPに関連する変異)、緑色(AHC, RDPの両方と関連する変異)、黄色(それ以外の症状と関連する変異)で、これまで報告された各々の疾患に関連する変異をプロットしている。今回見つかった変異は、βサブユニットとの相互作用部位に多い(左側の図のb, c, dのボックスで囲まれた領域。 eのボックスは例外的に細胞質内に存在する変異を示している)。AHC、RDP、その他の症状と関連する既知変異は、βサブユニットからは遠い部位に変異が集簇している傾向がある。
また、細胞を使った実験により、「多小脳回」関連変異としてp.Gln895Proの変異がある細胞では、細胞膜におけるαサブユニットとβサブユニットとの相互作用が低下していることがわかりました(図3)。比較対象としてAHC、RDP、CAPOSで報告されている変異の中で、代表として、RDPで報告されている変異(p.Ile758Ser)について、同様の実験を行うと、RDP変異では、αサブユニットとβサブユニットとの相互作用の低下は見られませんでした。このことにより、「多小脳回」においては、Na+/K+-ATPaseのイオンチャンネルとしての機能がAHC, RDP, CAPOSとは異なる機序により障害されていることが想定されました。
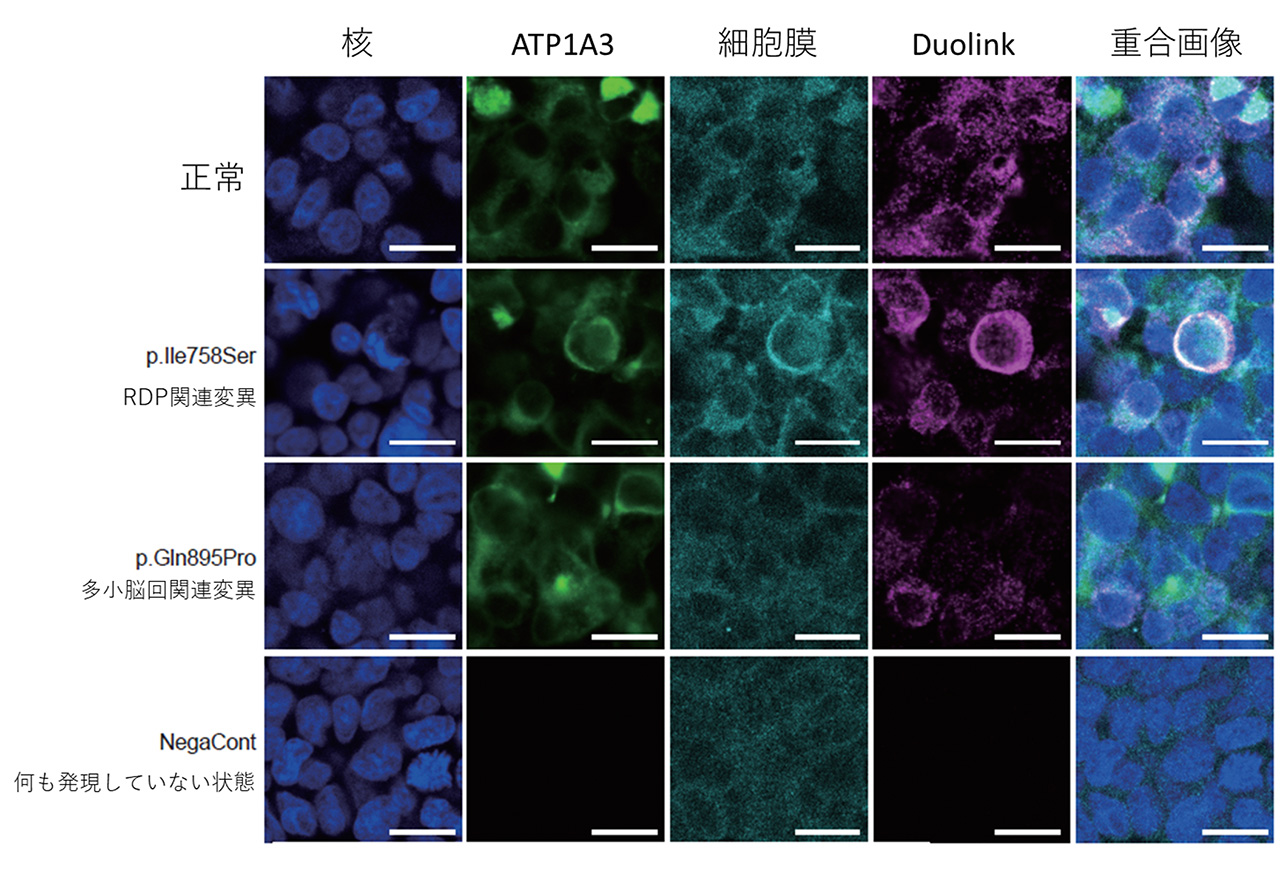
図3. 細胞膜上における、Na+/K+-ATPaseのα/βサブユニットの相互作用
In situ PLA fluorescence法*4を応用したDuolinkを用いて、細胞膜上でのNa+/K+-ATPaseのα/βサブユニットの相互作用を調べた。正常のATP1A3 遺伝子を発現させた細胞(図の正常と書いてある行にある5つの図を見てください)、RDP関連変異をもつATP1A3 遺伝子を発現させた細胞(図のRDP関連変異と書いてある行にある5つの図を見てください)に比べ、「多小脳回」関連ATP1A3 遺伝子変異を発現させた細胞(図の「多小脳回」関連変異と書いてある行にある5つの図を見てください)では、細胞膜上のDuolinkシグナル(図のDuolinkと書いてある列にある上から3つの図を比較して見てください)が有意に減少しており、αサブユニットとβサブユニットとの相互作用が低下していることが確認された。(図の何も発現していない状態と書いてある行にある5つの図は、何も手を加えていない細胞の状態の場合にこれら5つの図がどう見えるかを示したもので比較対象として提示しています。)各図の右下の白線=20 μm。
次に、マウスの胎仔で、今回見つかった変異のうち、最も重篤な症状を呈したATP1A3 遺伝子変異を発現させると、マウスの大脳皮質の形成に関わるニューロンの移動が障害されました(図4)。
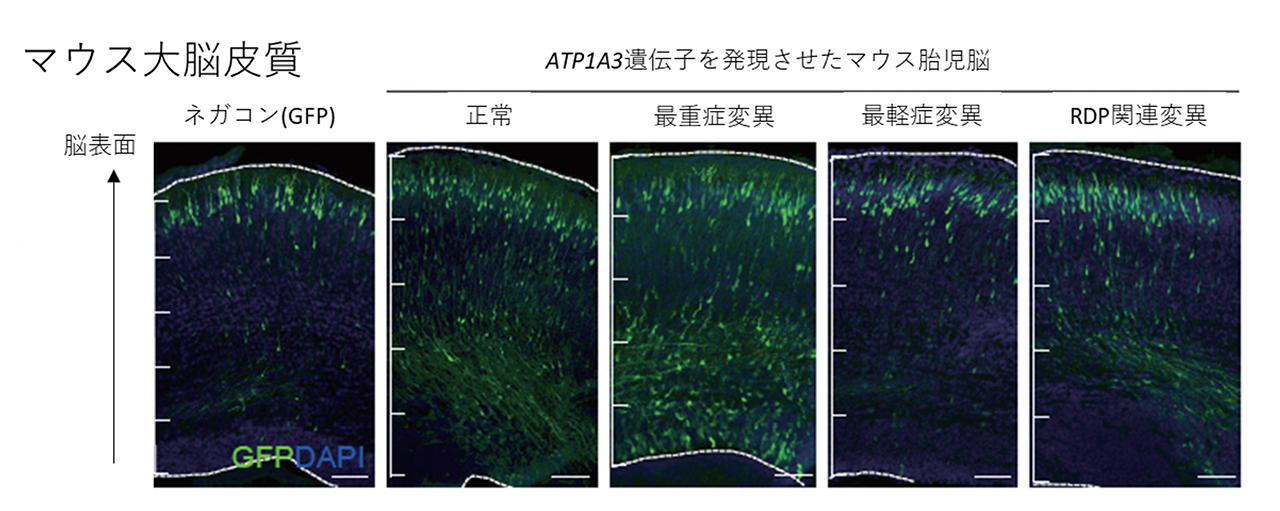
図4. ATP1A3 遺伝子変異による神経細胞の移動障害
胎生14.5日のマウス脳に、子宮内エレクトロポレーション法*5を用いて、ATP1A3 遺伝子と蛍光たんぱく質をコードするGFP遺伝子を導入し、ATP1A3 遺伝子を発現している神経細胞が緑色に光るようにしている。このコンディションで胎生18.5日の脳を観察した。神経細胞は、正常では脳表面に向かって移動し、皮質を形成することが知られている。「多小脳回」関連の最重症例に関連した変異(最重症変異)を発現させたマウス胎仔脳では、正常のATP1A3 遺伝子, RDP関連変異を発現させた場合に比べて脳表面への移動が障害されている(脳の表面から遠いところに緑色に光る神経細胞が残留している)。
ATP1A3 遺伝子の変異は、小児交代性片麻痺などの機能性の脳疾患を呈するというのがこれまでの一般的な理解でしたが、本研究成果は、本遺伝子変異によって脳形成異常を主徴とする全く別の疾患が起こることを明らかにしたものです。既知の疾患に関連したATP1A3 変異では、主に脳の機能に異常をもたらすものだったのに対して、今回見つかったATP1A3 変異では、主に脳の形成が異常になることが示された点が、これまでの常識を覆す成果です。また本研究で、イオンチャンネル異常と「多小脳回」の関連が示されました。今後の「多小脳回」の病態解明や、小児神経診療における診断率の向上、治療方法の開発に寄与することが期待されます。

※ 本研究は、国立研究開発法人日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「新技術を用いた難治性疾患の高精度診断法の開発」(研究代表者:松本直通)、厚生労働省、日本学術振興会、武田科学振興財団、内藤記念科学振興財団、サントリー生命科学財団の支援により実施されました。