当研究所 ユビキチンプロジェクトの吉⽥雪⼦主席研究員・松⽥憲之プロジェクトリーダー、⽥中啓⼆理事⻑らは、京都⼤学 岩井⼀宏教授、 理化学研究 所開拓研究本部鈴⽊糖鎖代謝⽣化学研究室の鈴⽊匡主任研究員(T-CiRA PI-兼任)、武⽥薬品⼯業株式会社リサーチ、T-CiRAディスカバリー 朝⽐奈誠主任研究員・兎澤隆⼀主席研究員らと共同で、ヒト希少遺伝疾患「NGLY1⽋損症」の発症メカニズムを提唱しました。本研究成果は、「NGLY1⽋損症」の治療法の開発につながるものと期待できます。
この研究成果は、2021年7月3日4時(日本時間)に米国科学誌「PNAS」のオンライン版に掲載されました。

NGLY1(細胞質ペプチド:N−グリカナーゼ)は、細胞質内でタンパク質のN型糖鎖(注1)を根元から切断する酵素で、私達の身体の中で間違って合成され、構造が異常になったタンパク質のクリアランスに関わっています(注2)。2012年、エクソーム分析によってNGLY1欠損症の患者が海外で発見されました。NGLY1欠損症は、発育不全、四肢の筋力低下、不随意運動、てんかん、脳波異常、無涙症、新生児の肝機能障害等を引き起こす重篤な疾患です。NGLY1欠損症の娘をもった両親が設立したGrace Science財団  が積極的に治療法開発を支援し、世界中で研究が加速しているにもかかわらず、未だ発症の詳細なメカニズムや治療法の開発は道半ばです。理化学研究所・T-CiRAでは、NGLY1欠損症の治療法の開発を目指し、これまでに患者の症状と類似した表現型を示す動物モデルを開発してきました。その中で、研究に汎用されるB6というマウス系統においては、NGLY1遺伝子を欠損すると胚性致死であることを報告しています。
が積極的に治療法開発を支援し、世界中で研究が加速しているにもかかわらず、未だ発症の詳細なメカニズムや治療法の開発は道半ばです。理化学研究所・T-CiRAでは、NGLY1欠損症の治療法の開発を目指し、これまでに患者の症状と類似した表現型を示す動物モデルを開発してきました。その中で、研究に汎用されるB6というマウス系統においては、NGLY1遺伝子を欠損すると胚性致死であることを報告しています。
N型糖鎖を持つ糖タンパク質の糖鎖は、一般的には細胞の外側、あるいは細胞内小器官の膜の内側を向いているため、細胞質側には存在しませんが、細胞質には、脱糖鎖酵素NGLY1と共に糖鎖に結合して、プロテアソームによる分解を引き起こすシグナルとなるユビキチン鎖(注3)をつける酵素が複数存在します(図1)。本研究グループは、NGLY1遺伝子欠損B6マウスにおいて、この糖鎖認識ユビキチン付加酵素(注4)のひとつであるFBS2の遺伝子も同時に欠損させることで、胚性致死を回復させ、ほぼ正常に生育することを見出しました(図2)。つまり、FBS2が、NGLY1のない状態では生体に異常を引き起こす可能性があると考えました。
次に、この仮説が正しいかを調べるために、NGLY1遺伝子を破壊した培養細胞にFBS2を発現させたところ、細胞が増殖せず、そのうち細胞死を起こすことを見出しました。詳細に解析すると、NGLY1がない細胞でFBS2が働くと、分解シグナルであるはずのユビキチン鎖が異常についた糖タンパク質が細胞に溜まってしまい、プロテアソームの機能が落ちてしまうことがわかりました。プロテアソームは、細胞の増殖や恒常性の維持に欠かせない分解装置であり、うまく働かなくなると細胞は死んでしまいます。細胞にはプロテアソームの活性を維持する機構があり、プロテアソームは活性が低下すると、NRF1(注5)という転写因子により新たなプロテアソームが作られるようになりますが、FBS2がNRF1を異常にユビキチン化することで、プロテアソームの活性回復機能を損なうことも明らかになりました(図3)。
胚性致死のNGLY1遺伝子欠損マウスの組織中では、NRF1のユビキチン化が認められましたが、NGLY1/FBS2の二重遺伝子欠損マウスではユビキチン化がみられないことからも、生体内でも同じようにプロテアソーム活性の低下が致死性を引き起こしている可能性が考えられます。
本研究では、NGLY1⽋損症の発症メカニズムを明らかにしました。FBS2遺伝⼦⽋損マウスは異常な表現型がなく、NGLY1がない場合にFBS2が働くことが⽣体に悪影響を及ぼすと考えられることから、FBS2の活性を特異的に抑制することは、NGLY1⽋損症の治療につながる可能性があります。そのため、本研究で得られたマウスの知⾒がヒトにおいても同様であるかを、今後研究を進めていく予定です。
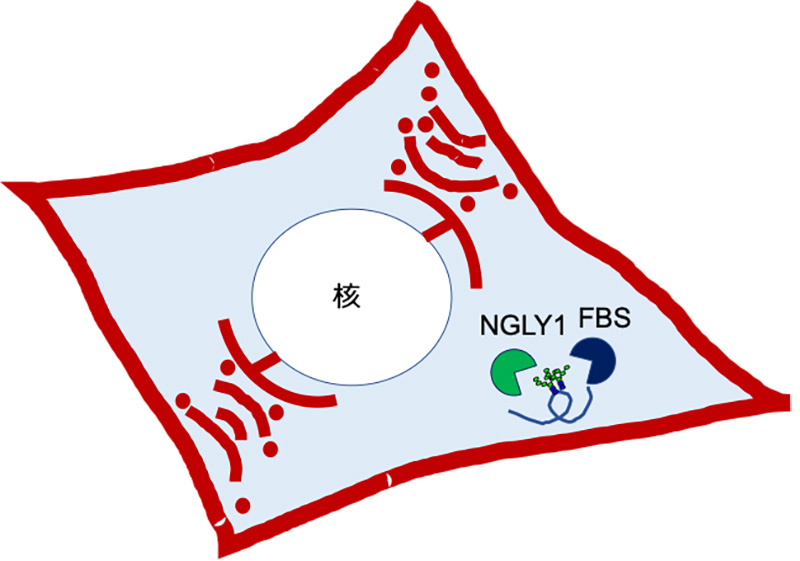
図1. 糖タンパク質の局在とは異なる細胞質に存在するNGLY1とFBS2
細胞の模式図。N型糖鎖を持つ糖タンパク質は、通常、赤で示す細胞膜の外や小胞体、ゴルジ体、リソソームなどの膜で囲まれた細胞内小器官内に存在する。しかし、一般的には糖鎖の存在しないはずの水色で示した細胞質には、脱糖鎖酵素NGLY1や糖鎖認識ユビキチン付加酵素サブユニットFBSが存在し、異常タンパク質として小胞体から細胞質へ戻された糖タンパク質を認識する。
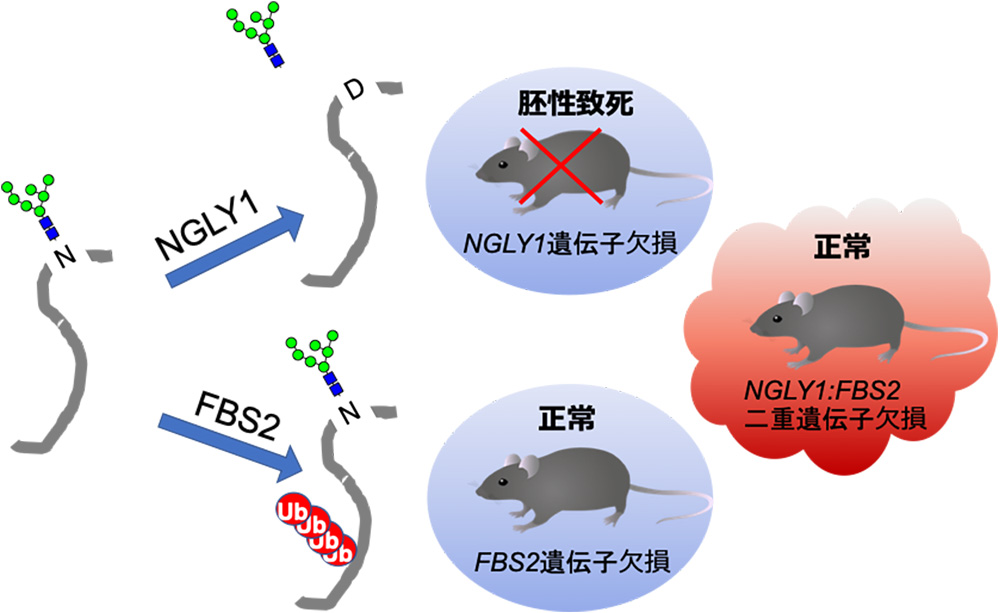
図2. NGLY1とFBS2の糖タンパク質に対する作用機序と遺伝子欠損マウスの表現型
NGLY1はN型糖鎖の根元から糖鎖を取り除く。その際、デアミダーゼ(注6)の反応により糖鎖の結合したアスパラギン(N)をアスパラギン酸(D)に変換する。FBS2は糖タンパク質のN型糖鎖に結合してタンパク質部分にユビキチン鎖を付加する。NGLY1遺伝子欠損マウスは胚性致死で、FBS2遺伝子欠損マウスは正常に発育する。これらの遺伝子の二重欠損マウスは正常に生まれて発育する。
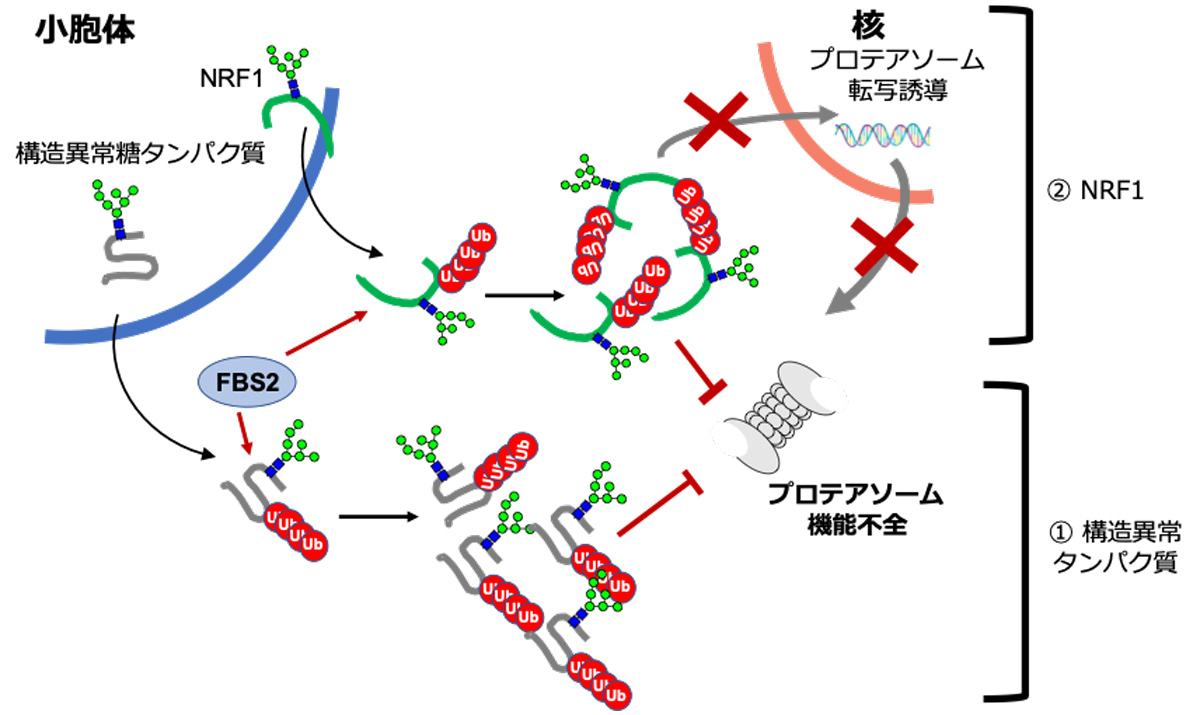
図3. NGLY1がない状態でFBS2がプロテアソームを機能不全にするメカニズム
細胞が増殖していく際にある確率で生じる構造異常の糖タンパク質は、小胞体から細胞質に放出され、NGLY1で糖鎖が外されプロテアソームで分解を受ける。しかし、NGLY1が無い場合、細胞質にN型糖鎖をもつタンパク質が蓄積し、FBS2に糖鎖が認識されてユビキチン化が高頻度に起こる。糖鎖とユビキチンを同時に持つタンパク質の蓄積は、プロテアソームに負荷をかけプロテアソーム阻害がかかる。プロテアソーム阻害がかかると、通常はNRF1が小胞体から核に移動して新しいプロテアソームを作るべく転写誘導を行うが、FBS2によりユビキチン化されたNRF1は核に行くことができず、プロテアソームを新たに合成できない。更に悪いことに、ユビキチン化されたNRF1もまたプロテアソームに負荷をかけ、プロテアソームは機能不全に陥り、細胞死を招く。
<本研究の主な助成事業>
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「プロテオスタシスの理解と革新的医療の創出」研究開発領域における研究開発課題「細胞質における糖鎖生物学―細胞恒常性維持の包括的理解を目指して」(研究開発代表者:鈴木匡)(20gm1410003)、日本学術振興会(JSPS)科学研究費補助金などの支援を受けておこなわれました。