当研究所認知症プロジェクトの樽谷愛理協力研究員、長谷川成人プロジェクトリーダーらは「タウオパチー患者脳由来タウ線維は基質選択的にタウの凝集を誘導する」について、英国科学雑誌「Brain」に発表しました。

タウオパチーはタウタンパク質の神経細胞及びグリア細胞内に線維化して蓄積する神経変性疾患の総称です。ヒト成人脳では6つのタウアイソフォームが発現していますが、微小管結合部位の繰り返し配列の数により3リピート(3R)タウと4リピート(4R)タウに大別されます。アルツハイマー病(AD)では3Rタウと4Rタウの両方が、ピック病(PiD)では3Rタウだけが、進行性核上性麻痺(PSP)及び大脳皮質基底核変性症(CBD)では4Rタウだけが線維構造をとり、多様な病理構造物を形成し神経変性を起こします。患者脳に蓄積するタウ線維は疾患ごとに異なる生化学的性質や超微形態を示すことが知られています。さらに近年、クライオ電子顕微鏡を用いた構造解析により、タウオパチー患者脳のタウ線維が疾患ごとに異なる折りたたみ構造をとっていることが原子レベルで明らかにされました。しかしながら、なぜ様々なタウ病理が生じるのか?どのようにそれぞれの疾患を特徴づけるタウ病理がその病理形態を引き継ぎながら脳内に広がるのか?については明らかではありませんでした。
近年の研究からタウ線維の構造多型がタウオパチーの臨床学的、病理学的多様性に寄与することが示唆されています。そこで本研究では、タウオパチー患者脳で起こると考えられる鋳型依存的なタウ 凝集、及び線維形成が培養細胞内で再現されるかを検討しました。
まず我々はAD、PiD、PSP、及びCBDと病理診断されたタウオパチー患者脳から界面活性剤不溶性画分を抽出し、これらに含まれるタウ線維をHAタグ付き3Rタウもしくは4Rタウを発現するヒト神経芽腫SH-SY5Y細胞に導入しました(図1)。すると、AD及びPiD脳から抽出したタウ線維は3Rタウの凝集を、AD、PSP及びCBD脳から抽出したタウ線維は4R タウ の凝集を誘導しました。この基質選択的な不溶性タウの蓄積は3Rタウと4Rタウの両方を発現させた細胞においても同様に観察されました。興味深いことに、患者脳由来タウ線維を導入した培養細胞の不溶性画分を電子顕微鏡で観察すると、患者脳から抽出したタウ線維に類似した線維構造が多数観察されました(図2)。またこれらの線維はHA抗体及びタウ抗体で標識されることから、培養細胞内に発現させたタグ付きタウが患者脳由来タウ線維を鋳型に線維を形成したことが示唆されました。さらに、線維導入細胞から抽出した不溶性タウは、導入したタウ線維に類似した生化学的性質を示すだけでなく、培養細胞を複数回継代したあとも基質選択的なタウ凝集を引き起こす能力を保持していました。
以上の結果から、タウオパチー患者脳から抽出したタウ線維の導入により鋳型依存的なタウ凝集及び線維形成が培養細胞内で再現されることが示されました。本研究で観察される基質選択的なタウ凝集は患者脳由来タウ線維の構造の違いにより引き起こされると考えられます(図3)。クライオ電子顕微鏡を用いた構造解析により、AD患者脳由来タウ線維の中心構造は3Rタウと4Rタウに共通するアミノ酸配列から構成されているのに対し、PiD、PSP及びCBD患者脳由来タウ線維の中心構造はそれぞれ3Rタウ、もしくは4Rタウ特異的な配列から構成されることがわかっています。すなわち鋳型タウと基質タウのアミノ酸配列が一致しない場合には、構造的に不安定となりタウ凝集が促進されないと考えられます。今回の結果から脳内における鋳型依存的なタウ凝集が疾患を特徴づけるタウ病理の形成及びその脳内伝播において重要なプロセスであることが強く示唆されます。また本研究で確立された患者脳由来タウ線維を用いた培養細胞モデルは孤発性タウオパチー病態を再現するモデルとして有用であり、タウオパチーの新規治療薬開発に役立つことが期待されます。
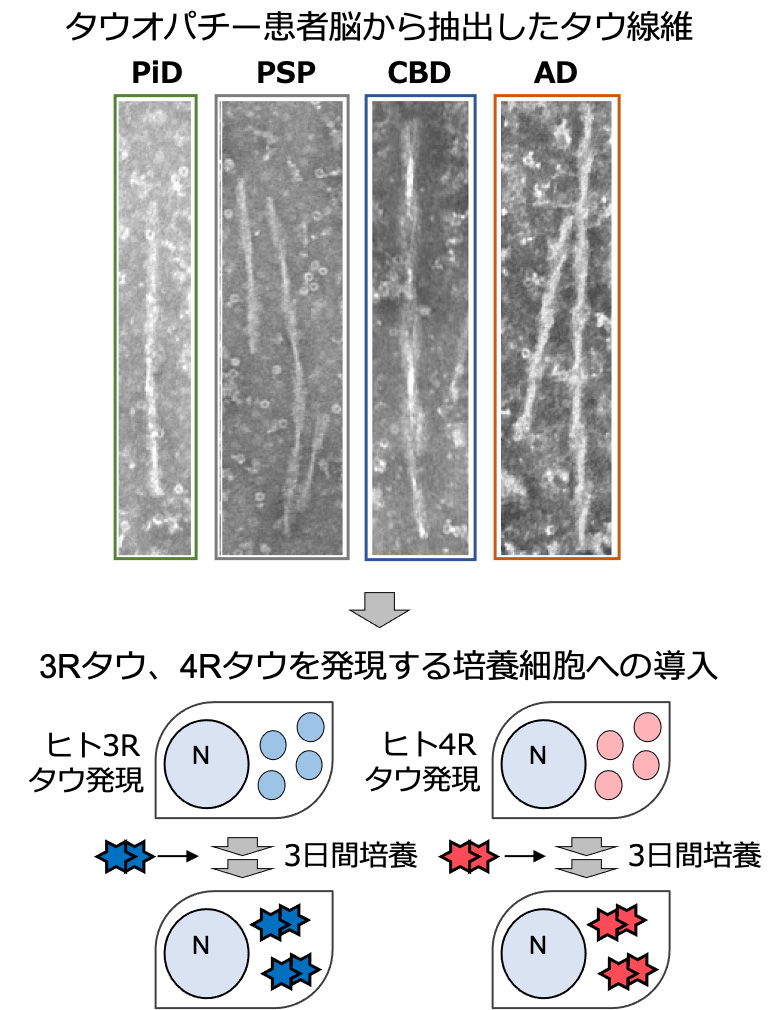
図1.タウオパチー患者脳由来タウ線維を用いたタウ凝集モデル
タウオパチー患者脳からタウ線維を抽出し、それをシード(種)としてタウを発現する培養細胞に導入した。3日間の培養後、培養細胞からサルコシル不溶性画分を回収し、タウの凝集蓄積をイムノブロット、免疫組織染色及び免疫電子顕微鏡法により評価した。
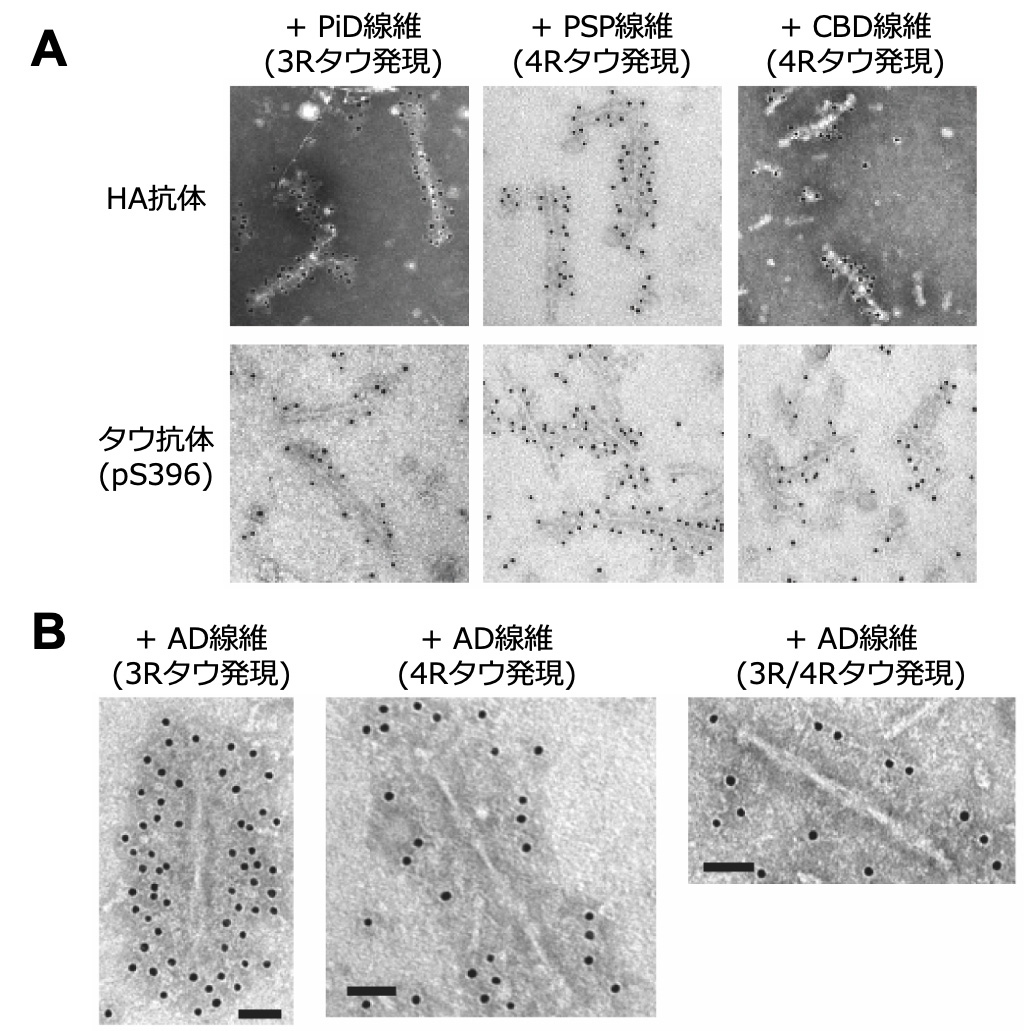
図2. タウ線維導入SY5Y細胞内に形成されたタウ線維
A. PiDタウ線維、PSPタウ線維及びCBDタウ線維を導入した培養細胞から回収した不溶性画分を電子顕微鏡で観察するとHA抗体及びタウ抗体により標識される線維構造が観察された。
B. ADタウ線維を導入した培養細胞から回収した不溶性画分を電子顕微鏡で観察すると、AD患者脳で観察されるpaired helical filament (PHF)に類似したタウ線維が観察された。このPHF様線維の形成は3Rタウもしくは4Rタウを単独で発現する細胞においても観察された。
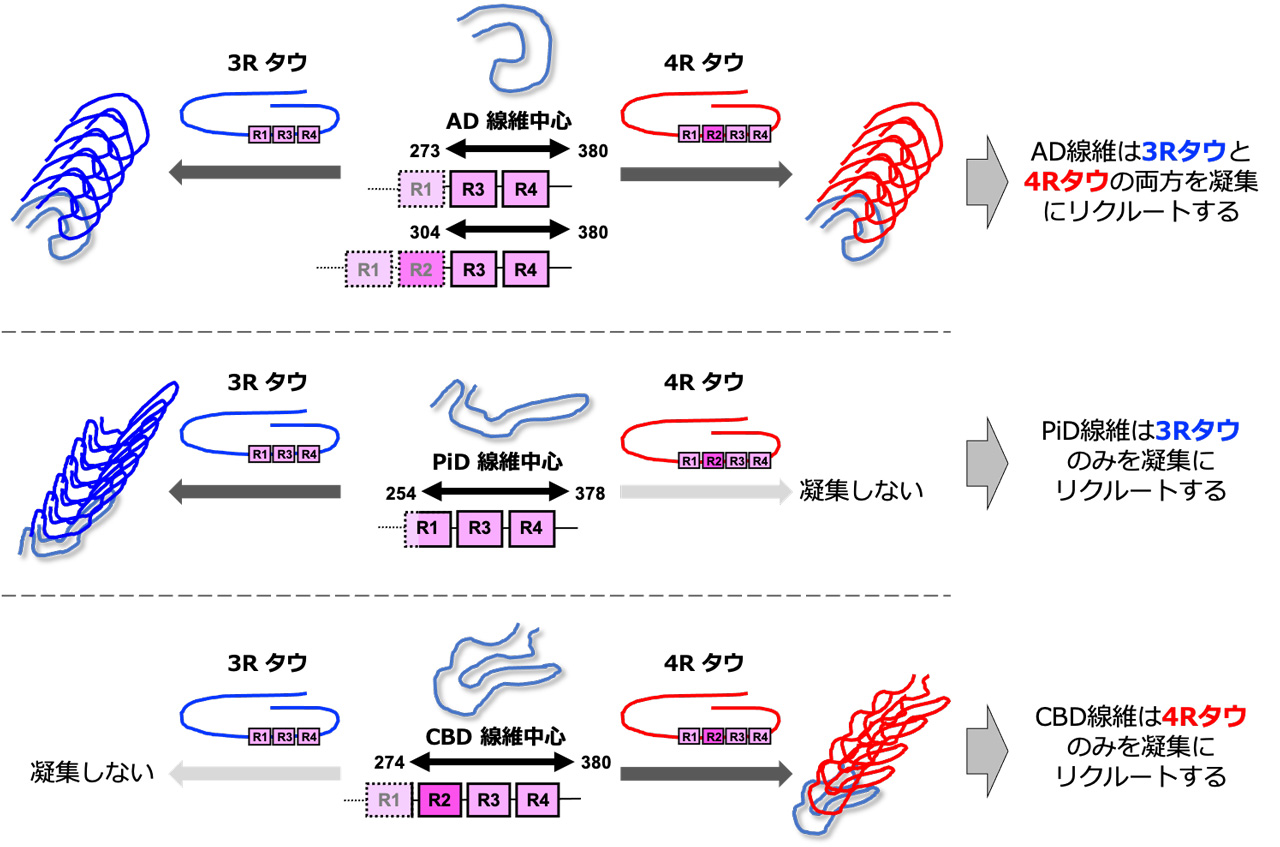
図3.タウオパチー患者脳における鋳型依存的なタウ凝集
本研究で観察された基質選択的なタウ凝集はタウオパチー患者脳由来タウ線維の中心構造の違いにより説明される。AD患者脳由来タウ線維は3Rタウと4Rタウに共通するアミノ酸配列から構成されるため、ADタウ線維は3Rタウと4Rタウの両方を凝集にリクルートする。PiD及びCBD患者脳由来タウ線維は3Rタウもしくは4Rタウ特異的な配列から構成されるため、鋳型タウと基質タウのアミノ酸配列がミスマッチな場合には凝集は起こらない。このような疾患ごとに異なるタウ線維構造はタウオパチーにおけるタウ病理の多様性の要となると考えられる。
本研究は日本医療研究開発機構(AMED)難治性疾患実用化研究事業の「大脳皮質基底核変性症の細胞、動物モデルの研究(代表 長谷川成人)」、JST-CREST「細胞外微粒子により惹起される生体応答の機序解明と制御(細胞外微粒子)」(代表 長谷川成人)、AMED「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」、日本学術振興会(JSJP)科学研究費助成事業などの研究助成支援により実施しました。