当研究所ユビキチンプロジェクトの山野晃史 主席研究員、小島和華 外部支援研究員、小谷野史香 主任研究員、松田憲之 参事研究員らは、田中啓二 理事長、国立医薬品食品衛生研究所の内藤幹彦博士、出水庸介博士、正田卓司博士らと共同で「ユビキチンで標識された損傷ミトコンドリアが OPTN(Optineurin) - ATG9Aの相互作用を介して選択的なオートファジー分解に導かれる」ことを発見し、米国科学雑誌 Journal of Cell Biology に発表しました。本研究は、日本学術振興会科研費、文部科学省科研費新学術領域研究「ケモテクノロジーが拓くユビキチンニューフロンティア」、文部科学省科研費新学術領域研究「マルチモードオートファジー」、(公財)武田科学振興財団の研究助成により実施しました。
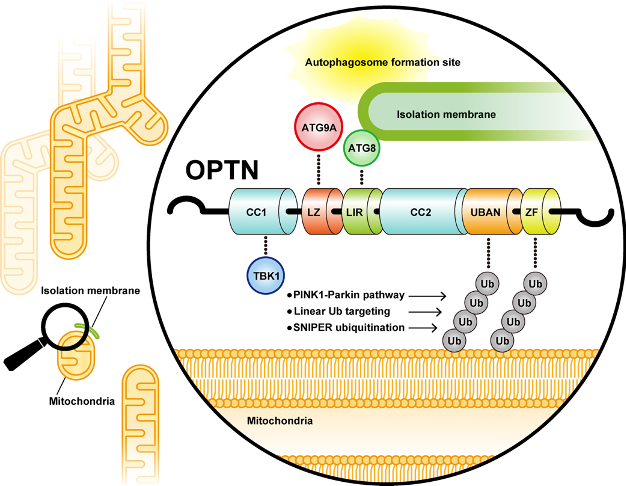

当ユビキチンプロジェクトでは、損傷ミトコンドリアの選択的なオートファジー分解(マイトファジー)の研究を進めています。我々は10余年にわたり、PINK1(セリン・スレオニンキナーゼ)とParkin(ユビキチン連結酵素:E3)が連動して損傷ミトコンドリアの外膜タンパク質をユビキチン化することで、マイトファジーを誘導することを明らかにしてきました(J Cell Biol 2010, Nat Commun 2012, J Biol Chem 2013, Nature 2014, J Cell Biol 2015, eLife 2018, EMBO Rep 2019 など:図1)。損傷ミトコンドリア特異的なマイトファジーの破綻はミトコンドリアの品質低下やROSの過剰産生に直結するものであり、遺伝性潜性パーキンソン病の発症のみならず孤発性パーキンソン病の発症にも関与することが示唆されています。
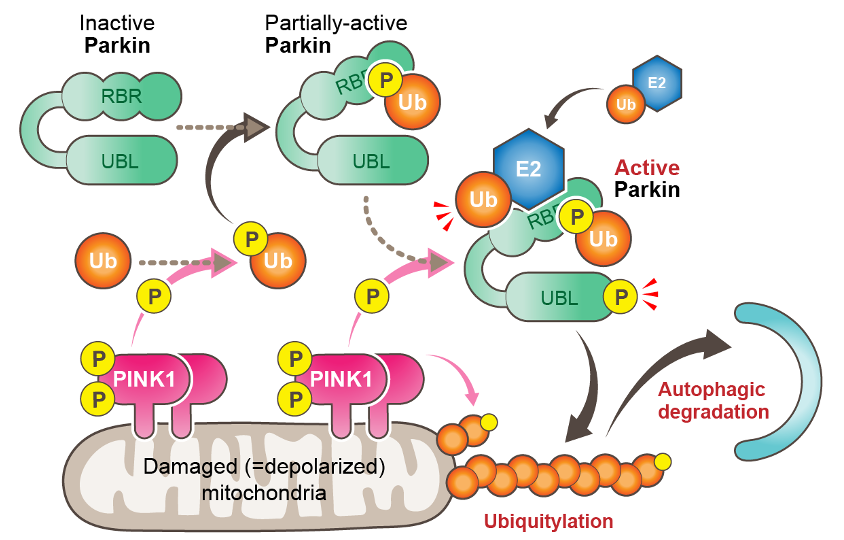
PINK1とParkinが損傷ミトコンドリアをユビキチン化することで、損傷ミトコンドリアの選択的なオートファジー分解(マイトファジー)を誘導する仕組みを模式的に示したもの。
細胞内で、ユビキチンは選択的オートファジーのシグナルとして機能しますが、その時には「一連のアダプタータンパク質がユビキチン鎖と結合し、さらにオートファゴソーム形成に関わる因子と相互作用することで、選択的オートファジーが誘導される」と考えられています。
哺乳類細胞では、ユビキチン結合活性を有する5種類のオートファジーアダプター(p62, NBR1, TAX1BP1, NDP52, OPTN)が知られていますが、PINK1/Parkinの関与するマイトファジーにおいては、OPTNとNDP52が主に機能していると考えられました。しかしながら、OPTNとNDP52がマイトファジーを誘導する分子メカニズムには未解明な点が残されていました。また、損傷ミトコンドリア上で蓄積するPINK1やPINK1が産生するリン酸化ユビキチンがオートファジーシグナルとして直接機能する可能性も考えられていました。山野研究員らは本研究を通じて、PINK1/Parkinによって付加されたユビキチン鎖がオートファジーシグナルとして読み出される新たな仕組みを解明しました。
我々はまず、直鎖状ユビキチン鎖を人為的にミトコンドリア外膜上に形成させること、またはSNIPERと呼ばれる化合物で特定のミトコンドリア外膜タンパク質にユビキチン鎖を付加させることでマイトファジーが誘導できることを見出しました。これらの結果はミトコンドリア表面上でユビキチン鎖が形成されることがマイトファジーの必要条件であることを示しており、PINK1それ自身やPINK1が産生するリン酸化ユビキチンはParkinの活性化に必須であるものの、オートファジーシグナルとして直接機能するものではないことを示唆しています。
次にマイトファジー誘導時におけるオートファジーアダプター群(p62, NBR1, NDP52, OPTN)の細胞内局在を調べたところ、全てが損傷ミトコンドリアに局在化しました。しかし、p62とNBR1がミトコンドリア全体に亘って局在するのに対して、NDP52とOPTNはミトコンドリアの一部(サブドメイン)のみに局在することを見出しました。オートファゴソームのマーカー分子であるLC3Bもこのサブドメインに局在したことから、NDP52とOPTNはユビキチン化されたミトコンドリアとオートファゴソームの結合部位(コンタクトサイト)に特異的に蓄積していると予想されました。
次に我々は、「ユビキチン鎖を認識したNDP52やOPTNと結合して、ユビキチン鎖をオートファジーシグナルに変換する分子の実態」に迫りたいと考えました。最も単純な解析方法はアダプター分子の相互作用因子を単離することですが、そのようなスクリーニングは既に多くの研究者によって行われており、斬新な手法を導入しなければ新たな知見が得られないと予想されます。そこで、タンパク質間相互作用を蛍光輝点に変換して高感度に検出できる Fluoppiシステム(Watanabe et al. Sci Rep 2017)を用いて、この課題に挑みました。Fluoppiシステムにおいては、ホモオリゴマー形成能を有するAshタグを融合したタンパク質(A)と、四量体形成能を有する蛍光タンパク質であるアザミグリーン(AG)を融合させたタンパク質(B)を共発現させます。AとBが結合する場合、AとBの相互作用・Ashタグの多量体形成・AGの四量体形成が連鎖的に引き起こされて、細胞内に液-液相分離による液滴が形成されます(図2)。我々はすでに Fluoppiシステムを用いた論文を複数報告しており(Koyano et al. Nature 2014; Yamano et al. J. Biol. Chem 2015)、使用実績があることもこの実験系を用いた理由の一つです。Ashタグをユビキチン鎖に融合させたタンパク質と、アザミグリーン(AG)をオートファジーアダプターに融合させたタンパク質を細胞内で共発現させたところ、液-液相分離による液滴が形成されました(図2)。
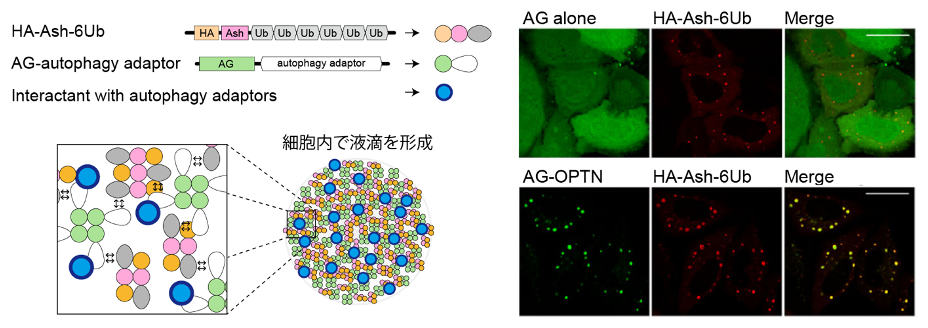
Fluoppiシステムの原理(左図)。ユビキチンとOPTNの相互作用・Ashタグの多量体形成・AGの四量体形成が連鎖的に引き起こされることで、細胞内に液滴が形成される(右図)。
上述のようにNDP52とOPTNはオートファゴソームのマーカー分子であるLC3Bとミトコンドリアのコンタクトサイトに局在することから、まずオートファジーアダプターとユビキチンの形成する液滴中にLC3ファミリータンパク質が含まれるかどうかを検討しました。すると、意外にもNDP52やOPTNの形成する液滴よりも、むしろp62やNBR1の形成する液滴の方がLC3ファミリータンパク質を含んでいる(より共局在している)ことが示されました。LC3とp62が相互作用することは小松博士ら(Komatsu et al. Cell 2007)によっても報告されていますが、先述のようにp62やNBR1はPINK1/Parkinの誘導するマイトファジーには必須ではないので、「LC3との結合能だけではマイトファジーにおけるNDP52やOPTNの必要性は説明できない」ことが示唆されました。
そこで、OPTNと結合してユビキチンシグナルをオートファジーシグナルに変換する分子の実態に迫るべく、OPTNとユビキチン鎖によって形成される液滴中に含まれるオートファジー関連因子(ATGタンパク質)を検索しました。まず ATG13, ATG14, WIPI2, ATG16L1 の局在を調べたところ、いずれもOPTNとユビキチン鎖の形成する液滴中には含まれずに、OPTN の形成する液滴の近傍に小さな点状に局在しました。この局在パターンは、“液滴をオートファジー分解の対象とみなして、オートファゴソーム膜で包み込もうとしている状態”を反映している可能性が高いと思われます。一方でATG9Aについて調べると、その局在がOPTNの形成する液滴に完全に一致することが示されました。他のオートファジーアダプター(NDP52, p62, NBR1)の形成する液滴中にATG9Aは含まれていなかったため、OPTN - ATG9A間に特異的相互作用があることが示されました。
最後に、OPTN - ATG9A間の相互作用がPINK1/Parkinの誘導するマイトファジーに必須であるのかどうかを検討しました。OPTNの部分欠失変異体やアミノ酸置換変異体を用いてATG9Aとの結合に必須な部位を絞り込む実験から、OPTNのロイシンジッパードメインがATG9Aとの結合に必須であることがわかりました。実際にロイシンジッパードメインに変異を導入したOPTNは、野生型OPTNと同様にユビキチン鎖と液滴を形成しますが、ATG9Aの液滴への局在能は完全に失われました。次に、ロイシンジッパードメインを介したOPTN - ATG9A間の相互作用がマイトファジーに必須かどうかを検討しました。全てのオートファジーアダプターを破壊した細胞(penta KO 細胞)に野生型OPTNまたはロイシンジッパードメインに変異を有するOPTNを入れ戻して、マイトファジー活性を測定しました。ミトコンドリア傷害薬で細胞を3時間処理した際のマイトファジー活性を定量測定したところ、penta KO 細胞で約3、penta KO 細胞に野生型OPTNを入れ戻した細胞で約75に対して、penta KO 細胞にロイシンジッパードメイン変異体を入れ戻した細胞では約20でした。この結果から、OPTN - ATG9A間の相互作用がPINK1/Parkinの誘導するマイトファジーに非常に重要であることが示されました。
2019年、オートファジーアダプターの一つであるNDP52がFIP200(オートファジー始動複合体の構成因子)と結合することで損傷ミトコンドリア上のユビキチンをオートファジーシグナルに変換することが報告されました(Vargas et al. Mol Cell 2019; Ravenhill et al. Mol Cell 2019)。山野研究員らによる本研究は、OPTNがATG9A(オートファゴソーム形成時に膜を供給する重要因子)と結合することを解明し、ユビキチン→ NDP52→ FIP200とユビキチン→ OPTN→ ATG9Aという2つの経路を介してPINK1/Parkinがマイトファジーを誘導することを見出したものです(図3)。これまでオートファジーアダプターはユビキチンとLC3の両方に結合するタンパク質と定義されていましたが、本研究は、オートファジーアダプター分子群に新たなオートファジー関連因子との繋がりを示しました。今後はFluoppiシステムを用いたこの研究をOPTN以外のオートファジーアダプターにも応用し、新たな相互作用因子を同定することで、選択的オートファジーの分子基盤の理解をさらに深めていきたいと考えています。
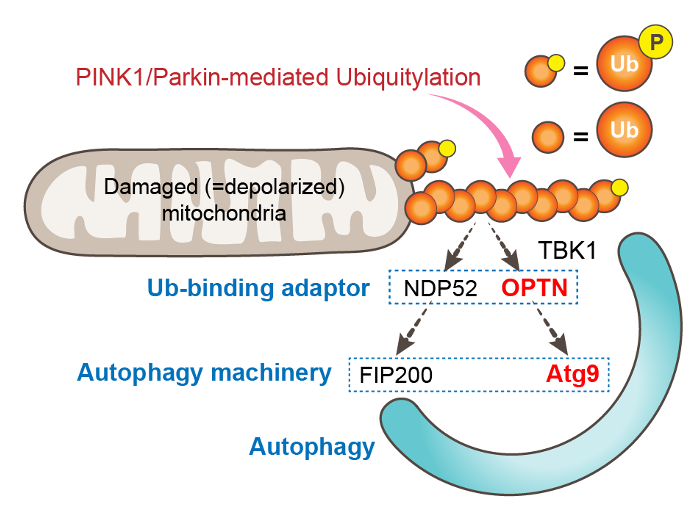
PINK1/Parkinによって損傷ミトコンドリアに付加されたユビキチン鎖は、NDP52 → FIP200経路とOPTN→ ATG9A経路を介して、マイトファジーを誘導する。