
アルツハイマー病をはじめとする神経変性疾患では多くの場合その病気に特徴的なタンパク質の線維状凝集体の蓄積が患者脳で観察されます。パーキンソン病、レビー小体型認知症、多系統委縮症などではαシヌクレイン(αSyn)というタンパク質の線維状凝集体の蓄積が観察され、これらの疾患はαシヌクレイノパチーと総称されます。凝集体が蓄積する部位と神経変性が起きる部位が相関していること、αシヌクレイン遺伝子に変異が生じることでこれらの疾患を発症することから、αシヌクレイン凝集体自身がαシヌクレイノパチーの病因であると考えられます。しかし、αシヌクレイン凝集体が病因であるのならば、αシヌクレイン凝集体にどのような毒性があるのか?αシヌクレイン凝集体により異なる疾患が引き起こされるのはなぜか?などはわかっていませんでした。
近年の研究からパーキンソン病、レビー小体型認知症、多系統委縮症の患者脳に蓄積しているαシヌクレインの線維状凝集体の構造はそれぞれ異なるということが明らかになってきました。そこで、我々は大腸菌を用いて精製した可溶性のαシヌクレインタンパク質を異なる条件下で線維状凝集体を形成しました。αシヌクレインの線維状凝集体を、塩(KCl)の非存在下(αSyn凝集体KCl-)と生理的条件の塩の存在下(αSyn凝集体KCl+)で形成し、これらの凝集体が異なる構造を持つことを確認しました。これらの凝集体を野生型マウスの脳内に注入したところ、αSyn凝集体KCl-を注入したマウスでは、αシヌクレイノパチーと同様にリン酸化したαシヌクレイン凝集体の蓄積が顕著に認められましたが、αSyn凝集体KCl+を注入したマウスではαシヌクレイン凝集体の蓄積はほとんど認められませんでした(図1)。
これらの凝集体をマウス初代培養神経細胞に導入したところ、マウス脳内に注入した時と同様に、αSyn凝集体KCl-を導入した神経細胞でのみリン酸化したαシヌクレイン凝集体の蓄積が顕著に認められました。また、αSyn凝集体KCl-を導入した神経細胞ではユビキチン化したタンパク質が蓄積していました。ユビキチン化したタンパク質はプロテアソームにより分解されることから、αSyn凝集体KCl-はプロテアソーム活性を阻害するのではないかと考えました。精製したプロテアソームのタンパク質分解活性を、それぞれのαSyn凝集体の存在下で計測したところ、αSyn凝集体KCl-の存在下でのみプロテアソームのタンパク質分解活性が低下することがわかりました。また、αSyn凝集体KCl-のみが精製したプロテアソームと相互作用することがわかりました。次にこれらのαSyn凝集体の構造のどの部分が異なるかを質量分析により解析したところ、αSyn凝集体KCl-ではαSyn凝集体KCl+よりαシヌクレインのC末端領域が露出していることがわかりました。そこでC末端領域を欠いたαシヌクレインを精製し、塩の非存在下で凝集体を形成し、得られた凝集体(αSynΔC凝集体KCl-)をマウス初代培養神経細胞に導入したところ、リン酸化したαシヌクレイン凝集体の蓄積はほとんど認められませんでした。また、SynΔC凝集体KCl-はプロテアソームと相互作用せず、活性も阻害しませんでした。αシヌクレインのC末端領域は負に荷電していることから、塩の存在の有無により異なる構造のαSyn凝集体が形成され、露出したC末端領域がプロテアソームの活性を阻害すると考えられます(図2)。
今回の結果から、αシヌクレイン凝集体の毒性はその構造により異なり、プロテアソームの活性を阻害するという毒性をもつ構造のものが存在することが明らかになりました。また、αシヌクレインの構造の違いにより引き起こされる病理が異なることの原因が明らかとなり、今後αシヌクレイノパチーの発症メカニズムの解明につながることが期待されます。
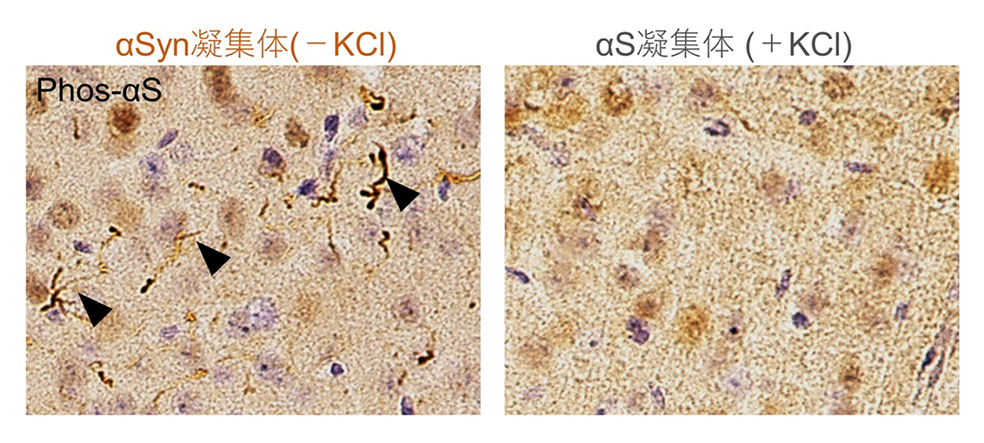
マウス脳内にそれぞれのαシヌクレイン凝集体を注入し、一か月後に現れたリン酸化αシヌクレイン凝集体の蓄積。αSyn凝集体(-KCl)を注入したマウス脳内では顕著なリン酸化αシヌクレインの蓄積(矢頭)が認められたが、 αSyn凝集体(+KCl)を注入したマウス脳内ではほとんど認められなかった。
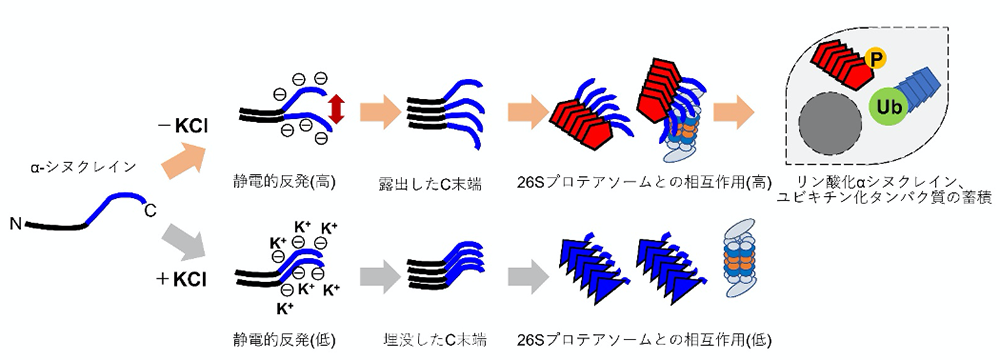
αシヌクレインはC末端領域に負に荷電した領域(青)がある。塩(KCl)の非存在下で凝集体を形成するとC末端領域の静電的反発により、C末端領域が露出した構造の凝集体が形成される。この凝集体の露出したC末端領域がプロテアソームと相互作用し、その活性を阻害すると考えられる。このような構造の凝集体をマウスや細胞に導入するとリン酸化αシヌクレインの蓄積やユビキチン化タンパク質の蓄積が誘導される。一方、塩の存在下で凝集体を形成すると、静電的反発が抑えられ、C末端領域が埋没した構造の凝集体が形成される。この凝集体はプロテアソームと相互作用をせず、その活性も阻害しないと考えられる。