当研究所ユビキチンプロジェクトの小島和華 外部支援研究員、山野晃史 主席研究員、松田憲之 参事研究員らは、田中啓二 理事長、徳島大学 先端酵素学研究所の小迫英尊博士、産業技術総合研究所の今井賢一郎博士らと共同で、「哺乳類のオートファジー経路に関わる新規因子:BCAS3-C16orf70複合体」を発見し、米国科学雑誌Autophagyに発表しました。
本研究は、日本学術振興会科研費、文部科学省科研費新学術領域研究「ケモテクノロジーが拓くユビキチンニューフロンティア」、文部科学省科研費新学術領域研究「マルチモードオートファジー」、(公財)武田科学振興財団の研究助成により実施しました。

[Graphical Abstract]: 哺乳類細胞においてBCAS3とC16orf70複合体は、BCAS3のWD40ドメイン中の脂質結合領域を介して、オートファジーで形成される隔離膜上に局在化する。

我々の体を構成する細胞の中には、核やミトコンドリアなどの細胞小器官が存在し、様々なタンパク質が機能して生命活動を行っています。細胞には、例えば、タンパク質の材料となるアミノ酸が足りなくなった時に、既にある別のタンパク質を分解してアミノ酸を捻出したり、細胞小器官が故障した時にそれを分解して除去する「オートファジー」というシステムが備わっています。
当ユビキチンプロジェクトでは、損傷したミトコンドリアだけを限定的にオートファジー分解する「ミトコンドリアオートファジー(マイトファジー)」の研究を進めてきました。これまで10余年にわたる研究の中で、PINK1(リン酸化酵素)とParkin(ユビキチン連結酵素)が協調してはたらき、損傷ミトコンドリアにユビキチン(分解の標識となる小さなタンパク質)をつける、という一連の仕組みを明らかにしてきました(J Cell Biol 2010, Nat Commun 2012, J Biol Chem 2013, Nature 2014, J Cell Biol 2015, eLife 2018, EMBO Rep 2019 など)。
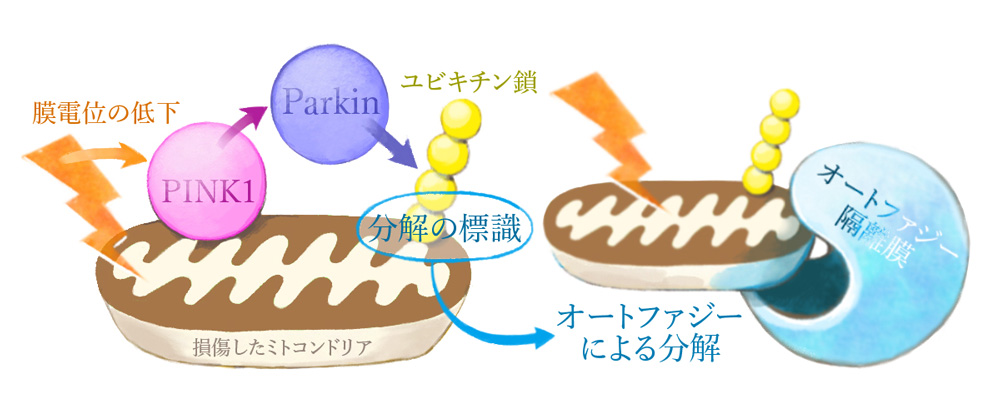
マイトファジーが破綻した場合、分解されずに残った損傷ミトコンドリアはエネルギー産生などの本来の機能を失っているばかりか、細胞にとって有害な物質を発生させます。その結果引き起こされる細胞死によって、パーキンソン病などの神経変性疾患が発症することが示唆されています。このように、オートファジーは細胞の健康を維持するための重要なシステムであり、そこでどんなタンパク質が機能するか、どのような場合にシステムが破綻してしまうかを知ることは、病気の発症を抑えるという医学的応用にもつながっていきます。
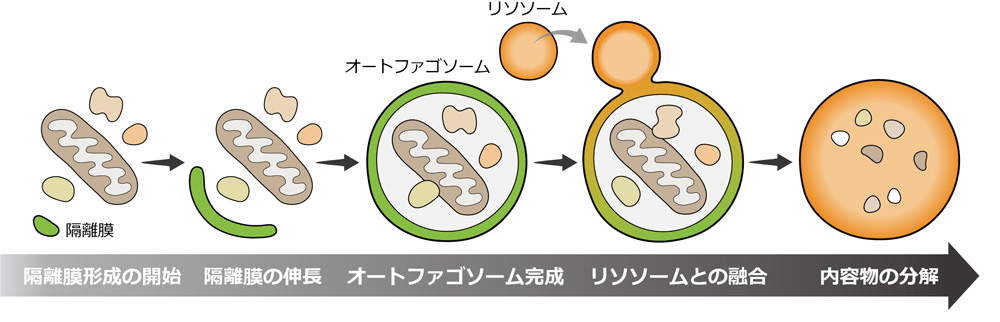
オートファジーでは、隔離膜という脂質二重膜が分解の標的を取り囲みます。膜は伸長し閉じ(閉じたものをオートファゴソームといいます)、リソソームと融合し、内容物はリソソーム内の分解酵素によって分解されます。2016年にノーベル賞を受賞された大隅先生が1993年に酵母を用いた研究によって主要なオートファジー因子群を発見されて以来、世界中の研究者が新規なオートファジー関連因子の探索を行ってきました。
オートファジーシステムは酵母から哺乳類まで進化的に保存された現象であり、酵母のオートファジーで機能する主要なタンパク質の多くが、ホモログとして哺乳類でも見つかっています。しかし、酵母よりもより複雑な生命活動を行う哺乳類においては、未知のオートファジー関連因子が未だ多く存在するに違いありません。今回我々は、哺乳類細胞を用いた研究により、そのような進化の過程で獲得された(酵母にホモログのない)オートファジー関連因子として2つの新規なタンパク質を発見しました。
私たちは、マイトファジー誘導条件において、既知のオートファジー因子をベイトとした免疫沈降実験-質量分析を行うことにより、効率的なオートファジー関連因子のスクリーニングを実現し、オートファジーシステムに関わることが知られていなかった2つのタンパク質:BCAS3とC16orf70を、新規オートファジー因子として同定しました(図1A)。
BCAS3とC16orf70は、通常時は細胞質に存在しますが、ミトコンドリアの膜電位を低下させると、その近傍に集まる様子が観察されました(図1B)。また、細胞をアミノ酸飢餓の状態にした時にも、細胞質で集積して輝点として観察されました。これによりBCAS3とC16orf70は、ミトコンドリア損傷やアミノ酸飢餓によって形成される隔離膜に集積することが示唆されました。また、タンパク質間相互作用を調べる実験や顕微鏡観察によって、BCAS3とC16orf70が結合して複合体を形成していることがわかり(図1C)、この両因子の結合を阻害してしまうとオートファジー時の集積も起こらないことがわかりました。
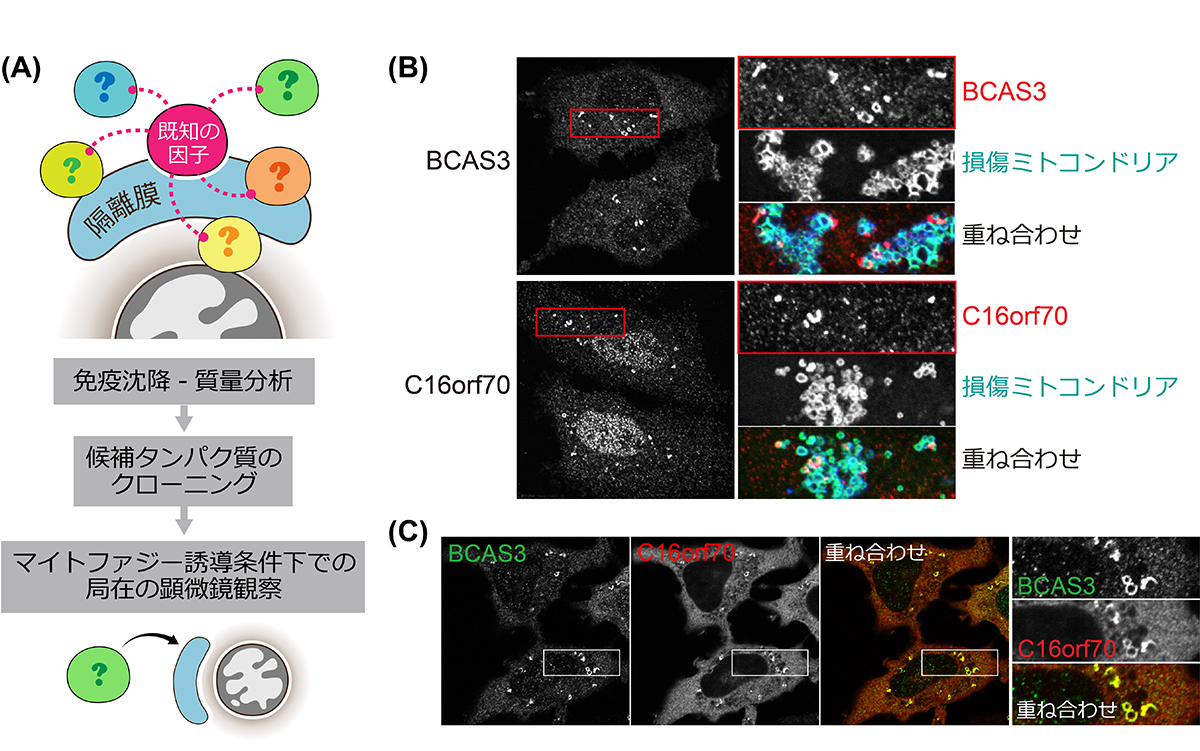
図1:(A)スクリーニング方法 (B)ミトコンドリアを損傷させる薬剤の処理(マイトファジーの誘導)により損傷ミトコンドリアの周辺にBCAS3およびC16orf70の輝点が観察された(赤枠)。(C)損傷ミトコンドリア周辺に観察されたBCAS3とC16orf70のシグナルはきれいに重なる。タンパク質間相互作用を調べる別の実験によってBCAS3とC16orf70は結合していることが示された。
BCAS3とC16orf70は、それぞれ単独で、あるいは両方を欠損させても、オートファジーは問題なく起こることがわかりました。一方で、BCAS3とC16orf70を過剰に発現させた条件では、オートファジーの進行に重要な役割を担ういくつかの因子の集積が阻害されていました。これらのことは、BCAS3-C16orf70がオートファジーシステムのON/OFFの制御に必須ではない一方で、オートファジーシステムの主要なステップである隔離膜の伸長において、他のオートファジー因子と協調してはたらくことを示唆しています。
さらに本研究では、BCAS3タンパク質の立体構造のモデリングを行い、隔離膜を構成する特定の脂質(PI3P:ホスファチジルイノシトール3リン酸)との結合部位を予測しました(図2A)。試験管内においてオートファジー膜を模した脂質膜を作製し、BCAS3タンパク質を混ぜて反応させると、PI3Pが含まれる場合にのみ、BCAS3がその膜に結合することが実験的にも示されました。また、BCAS3の脂質結合部位を構成するアミノ酸を別のアミノ酸に変えたり、領域を欠損させると隔離膜への集積が阻害されたので(図2B)、実際にBCAS3が予想された結合部位を介して隔離膜上の脂質と結合していることが強く示唆されました。
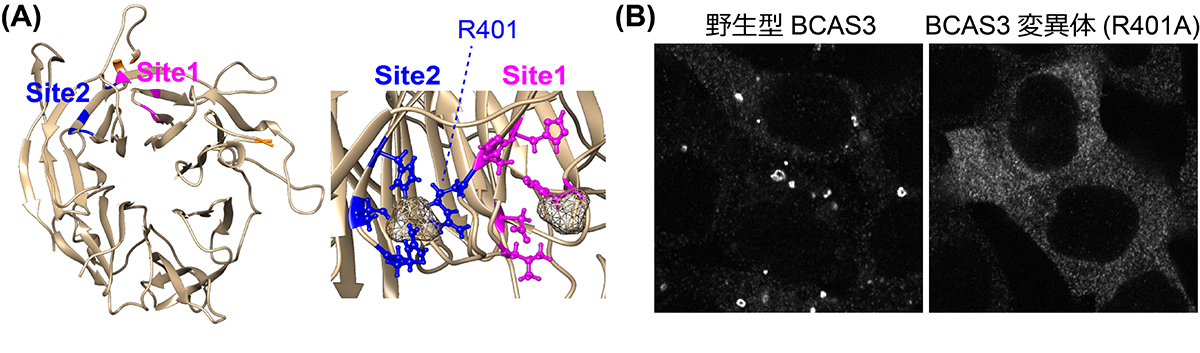
図2:(A)BCAS3は7つのβブレードから構成されたWD40ドメインを持つ。WD40ドメイン中に複数のアミノ酸(R401など)で構成された脂質結合ポケットを持つことが予測された。(B)脂質結合部位を構成するアミノ酸を変異させたBCAS3変異体(R401A)は、マイトファジーを誘導しても損傷ミトコンドリア周辺に集積しなかった。
以上のように本研究は、BCAS3-C16orf70複合体をオートファジーシステムにかかわる新しい因子として同定し、その隔離膜局在化の詳細なメカニズムを明らかにしました。
オートファジーでは様々な因子が重複した機能を持ってシステムを進行させるため、今回のように、特定の因子を欠損させてもその進行には影響が出ないことがしばしばあります。このような「非必須な関連因子」は、哺乳類のような複雑な生命活動を行う生物が直面しうる多様な状況に対応するための「柔軟性」をもたらす役割があるのではないかと考えています。システムの進行に必須ではない故に解析が難しい面がありますが、既知の非必須なオートファジー関連因子の中にはヒトの疾患の原因因子として報告のあるものもあり、今回発見されたBCAS3-C16orf70複合体についてもさらなる機能解析が求められます。