認知症プロジェクトの長谷川成人 プロジェクトリーダーらは、MRC Laboratory of Molecular BiologyのBenjamin Ryskeldi-Falconグループリーダー、愛知医科大学吉田眞理教授らとの共同研究により、「認知症を伴うALS患者由来の病的TDP-43線維の構造」について、英国科学雑誌「Nature」に発表しました。
筋萎縮性側索硬化症や多くの前頭側頭型認知症の特徴であるTDP-43の凝集構造が、低温電子顕微鏡を用いた解析により明らかになりました。


筋萎縮性側索硬化症(ALS、ルー・ゲーリッグ病)は、成人になってから発症する運動ニューロン疾患(MND)の中で最も多い疾患であり、前頭側頭型認知症(FTD)は、アルツハイマー病に次いで2番目に多い老年性認知症です。ALSと多くのFTDは、中枢神経系におけるTDP-43の異常凝集によって特徴づけられます。現在、これらの疾患の早期診断は不可能であり、疾患を改善する治療法もありません。これは、病的なTDP-43凝集体の構造が不明であることが一因です。しかし、今回、MRC Laboratory of Molecular Biology (LMB) 神経生物学部門のBenjamin Ryskeldi-Falconグループリーダーのグループは、日本の共同研究者と協力して、ALS及びFTD患者の様々な脳領域におけるTDP-43凝集体の構造を明らかにしました。
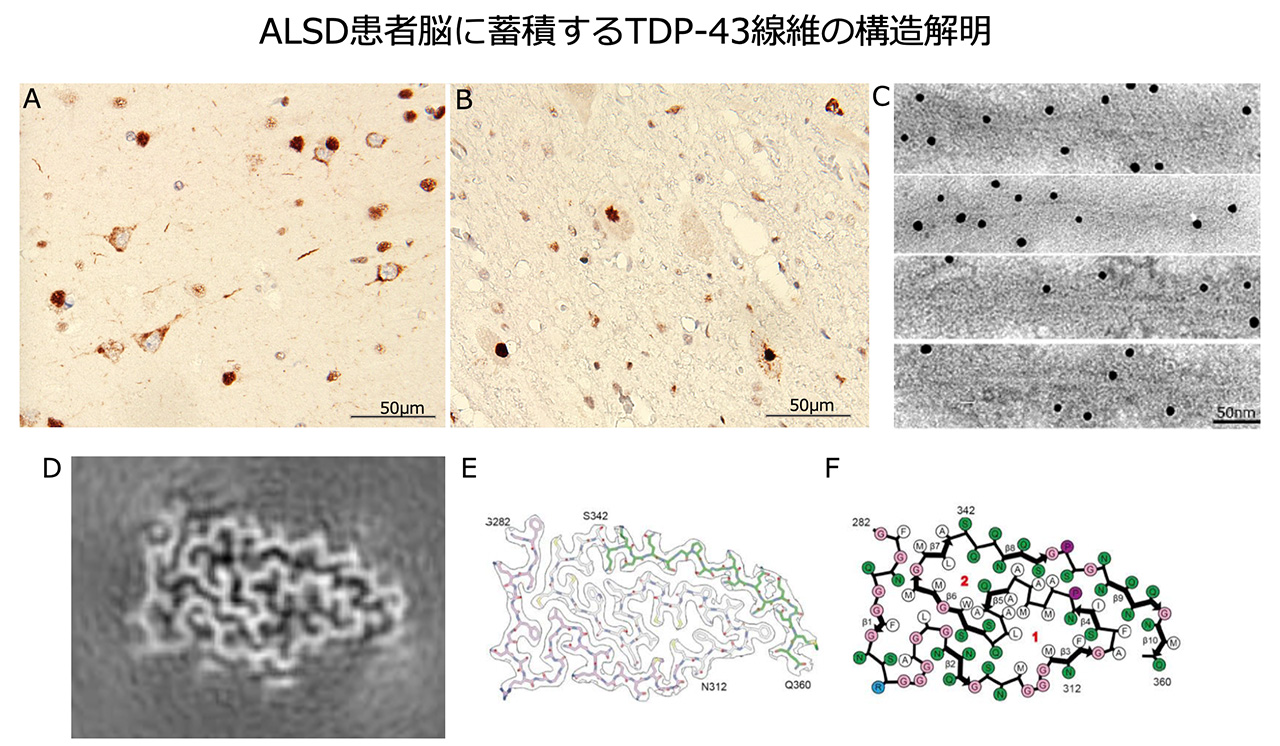
当研究所 認知症プロジェクトの長谷川成人プロジェクトリーダーらと愛知医科大学加齢医学研究所の吉田眞理教授は、ALS及びFTD患者の前頭葉及び運動皮質からTDP-43凝集体を含む試料を調製し、LMBグループに提供しました。LMBグループのポスドクであるDiana Arseni博士は、低温電子顕微鏡解析(クライオ電顕)を行い、ヘリカル再構成法を用いて、2.6オングストローム(Å)の分解能で構造を明らかにしました。
LMBグループの3人が構造を解析したところ、TDP-43分子が積み重なってできたアミロイド様の捻れた線維構造が明らかになりました。興味深いことに、構造化された線維中心は、らせん軸に垂直な方向に、これまで知られていなかったダブルスパイラル状の折り畳み構造をしていました。調べた全ての脳領域及び個人で同じ構造でしたが、実験モデル系でこれまでに形成されたTDP-43線維とは類似性を示しませんでした。
さらに研究チームは、線維中心が、複雑なアミノ酸組成を持たないTDP-43の領域によって形成されていることを発見しました。タウやα-シヌクレイン等の神経変性疾患に関わるタンパク質線維と比較して、構造的にも化学的にもユニークな線維表面が形成されていることがわかりました。また、線維表面と相互作用している、現在のところ化学的実態が不明な分子が観察されました。これらの結果は、TDP-43凝集を伴うALSやFTDの分子病態メカニズムが、他の神経変性疾患とは異なる可能性を示唆します。
TDP-43凝集体の構造と、他の神経変性疾患のアミロイド線維との違いを明らかにすることで、アミロイド線維に結合するよう開発されたトレーサー化合物による現在の診断法の有効性が低いことを説明できる可能性があります。重要なのは、一つのTDP-43線維構造がALSとFTDの両方の特徴であり、この構造が有効な治療標的となりうること、また、より効果的な診断標的となる結合部位となりうることを強調します。
本研究は、個人(及びその家族)からの脳の提供を受けて実施されました。
本研究は、UKRI MRC、Alzheimer's Research UK、日本医療研究開発機構(AMED)、科学技術振興機構(JST)から資金提供を受けて実施しました。