当研究所シナプス可塑性プロジェクトの久恒智博 主席研究員(現カルパインプロジェクト)、島田忠之 主席研究員(現こどもの脳プロジェクト)、山形要人 プロジェクトリーダー(現こどもの脳プロジェクト)らは、結節性硬化症型(TSC)ヒトiPS細胞を作製し、神経細胞に分化させてその性質を解析し、TSCのてんかん発症に関わる新たなメカニズムを明らかにしました。本研究成果は、TSCにみられるてんかんに対する治療薬の開発につながるものと期待されます。
本研究成果は、米国の科学雑誌「Journal of Neuroscience」のオンライン版(8月20日付け)に掲載されました。

※ こちらでも取り上げられています。
「JNeurosci Featured Research」
URL:https://www.jneurosci.org/content/featured-research
Twitter:https://twitter.com/SfNJournals/status/1438607638888132621
結節性硬化症(Tuberous sclerosis complex:TSC)は、皮膚、脳、腎をはじめとする全身の過誤腫を特徴とする難病です。TSC患者はてんかん発作・知的障害・自閉症などの神経症状をおこすことが知られています。なかでもてんかんは80%もの患者で発症することが知られ、知的障害や生活の質(クオリティ・オブ・ライフ)との関わりも高いとされています。
TSCの原因遺伝子はTSC1とTSC2です。TSC1、TSC2は複合体を形成し、低分子量Gタンパク質RhebのGTPase活性化因子[6]として機能します。このため、TSC1またはTSC2に変異が生じ機能不全になると活性化型のRhebが増加し、その下流のリン酸化酵素mTORC1を中心とした様々なシグナルカスケードが活性化されて神経症状が発症すると考えられています。しかし詳細な発症機構は明らかとなっていませんでした。
今回研究グループは、CRISPR-Cas9システム[7]によりヒトiPS細胞のTSC2遺伝子に変異を導入し、得られたTSC2欠損型のiPS細胞を大脳興奮性神経細胞に分化させてその性質を調べました。まずカルシウムイメージング法により神経ネットワークレベルの自発的な神経活動を明らかにした結果、TSC2欠損型神経細胞は正常型の神経に比べて高頻度かつ同調的な発火がみられることがわかりました。またTSC2欠損型神経細胞の軸索は異常に長いことがわかりました。TSC2欠損型神経細胞でみられた同調的な発火や異常な軸索伸長はともにmTORの活性阻害剤で抑制されたことから、mTORの活性化により軸索が長くなり、より密接な神経ネットワークが形成されて同調的発火が起こっていることが考えられました。
次に研究グループは個々の神経細胞レベルで細胞内カルシウムシグナルをさらに詳細に調べました。その結果、脱分極刺激時の細胞外からのカルシウム流入がTSC2欠損型神経細胞では増大しており、mTOR阻害剤で処理するとカルシウム流入が正常型神経と同等に戻ることがわかりました(図1)。また正常型の神経細胞に活性化型のRhebを発現させると脱分極刺激時のカルシウム流入が増大することもわかりました。このカルシウム流入の増大はL型カルシウムチャネルの発現が上昇することに起因することも明らかにしました。
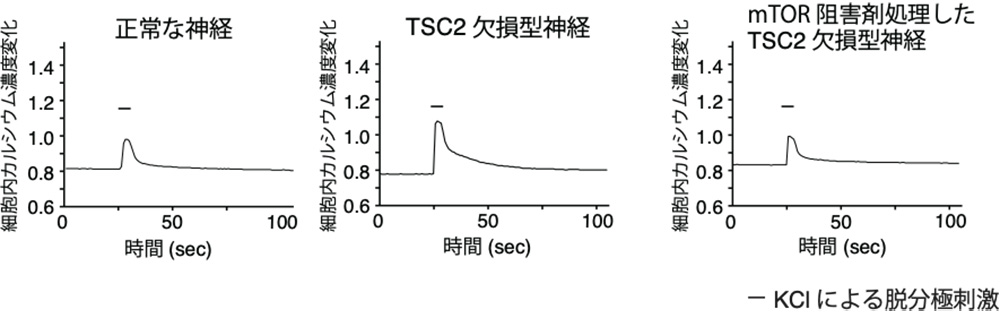
図1.TSC2欠損型神経細胞の脱分極刺激による細胞内カルシウム濃度変化
KClによる脱分極刺激(図中の棒線)を起こした際、TSC2欠損型神経細胞(真ん中)では細胞内カルシウム濃度の上昇が正常型神経細胞(左)に比べて大きい。一方、mTOR阻害剤で処理したTSC2欠損型神経細胞(右)ではカルシウムの流入の大きさが正常に戻る。
最後に、L型カルシウムチャネルからのカルシウム流入の増加が、TSC2欠損型神経細胞の軸索伸長や転写因子の活性化に与える影響を調べました。まず、軸索伸長への影響を調べるために、TSC2欠損型神経細胞と正常型神経細胞をL型カルシウムチャネルの阻害剤の存在下で培養したところ、軸索の伸長の抑制効果がTSC2欠損型神経細胞でより大きいことがわかりました。またシナプス可塑性[8]に関与する転写因子“CREB”の133番目のセリン残基のリン酸化状態を脱分極刺激後に時間を追って調べた結果、TSC2欠損型神経細胞ではCREBの持続的なリン酸化がみられました。一方mTOR 阻害剤で処理したTSC2欠損型神経細胞では、正常型神経細胞と同様にCREBのリン酸化状態が一過的になることがわかりました。
本研究によって、TSC-mTORシグナルの下流でL型カルシウムチャネルの発現が制御され、mTORの活性化により増大したカルシウム流入が神経細胞の軸索伸長や神経可塑性を制御する転写因子CREBの活性に影響することが示唆されました(図2)。神経細胞の細胞内カルシウム濃度は神経細胞の興奮性と密接に関わりがあることがわかっています。本研究の成果は、TSCのてんかんなどの神経症状に細胞外カルシウム流入の増大が関与する可能性を示唆しており、カルシウムチャネルを標的とした治療薬の開発につながる可能性があります。TSC患者由来の神経細胞でも今回得られた現象がみられるのかが次の重要な課題です。
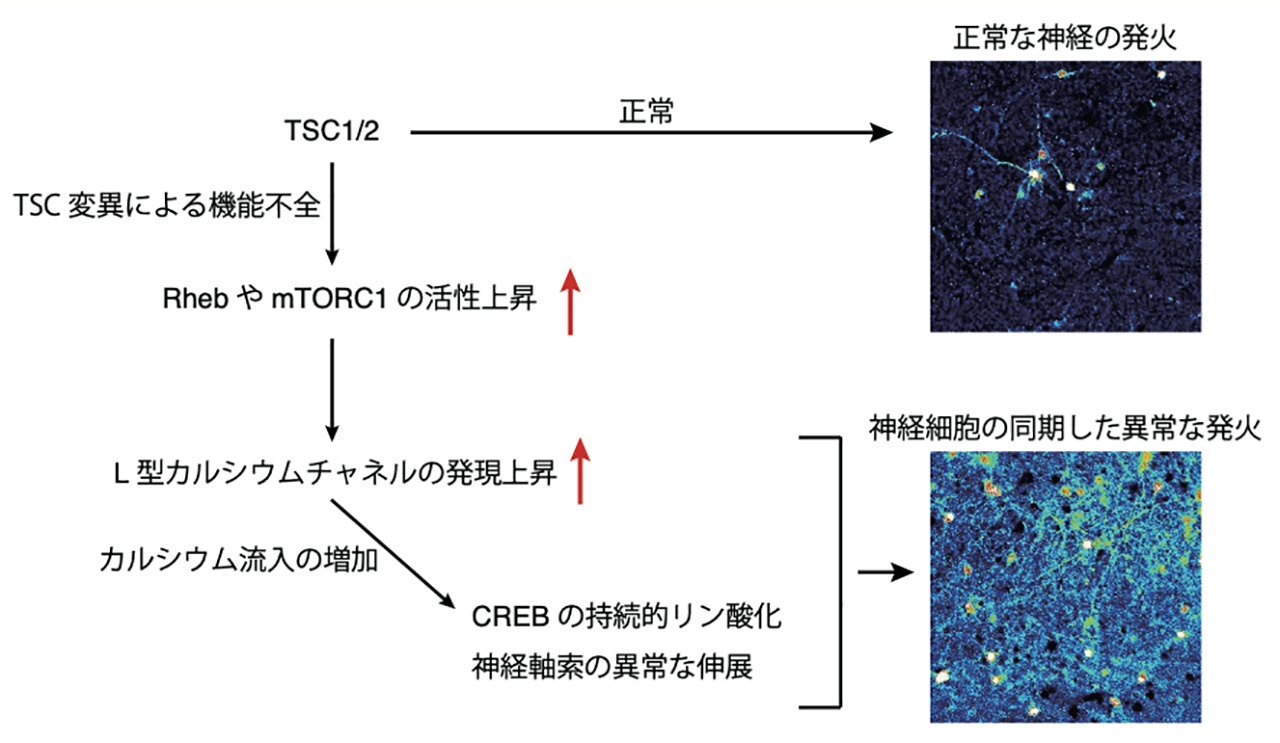
図2. 今回の研究で明らかになった成果の概要
TSCの変異によりRhebやmTORC1の活性が上昇し、L型カルシウムチャネルの発現が上昇する。その結果、カルシウム流入が増加し、転写因子CREBのリン酸化や神経軸索の伸展に異常が生じて神経の同期的発火がみられるようになると考えられる。正常な神経細胞では数個の神経細胞のカルシウム上昇(疑似カラーでカルシウム上昇を示す細胞が着色されている)がみられるのに対し(上)、TSC2欠損型神経細胞では細胞が一斉に発火して多くの細胞で同期したカルシウム上昇がみられる(下)。
本研究は、日本学術振興会(JSPS)科学研究費基盤研究(B)(研究代表者:山形要人、Grant Number JP25293239/18H02536)、科学研究費基盤研究(C)(研究代表者:久恒智博、Grant Number 19K08334)、国立研究開発法人日本医療研究開発機構(AMED) (研究代表者:山形要人、Grant Number JP18ek0109311h0001/19ek0109311h0002/ 20ek0109311h0003)、公益財団法人 先進医薬研究振興財団(研究代表者:山形要人)の研究費支援を受けて行われました。