睡眠プロジェクト 副参事研究員宮川 卓
副参事研究員本多 真
ナルコレプシーは、睡眠発作、情動脱力発作(カタプレキシー)、睡眠麻痺及び入眠時幻覚を主な症状とする代表的な過眠症です。ナルコレプシーには遺伝要因が関わることが知られています。私たちの研究グループでは、これまでに代謝関連遺伝子のカルニチンパルミトイルトランスフェラーゼ 1B(CPT1B)遺伝子に位置する SNP(一塩基多型)が、ナルコレプシーやその他の過眠症の発症と関わることを報告してきました。またこの SNP の発症リスクアリルをもつ群では CPT1B の発現量が有意に低いことも明らかにしています。
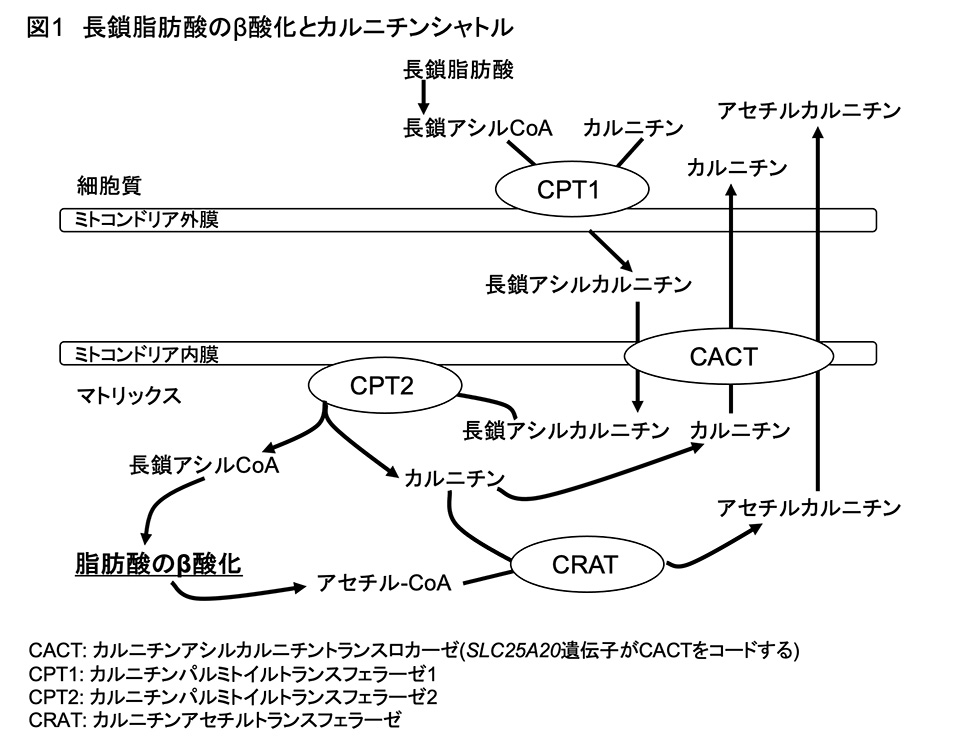
CPT1B は長鎖脂肪酸のβ酸化に関わる律速酵素です。長鎖脂肪酸から変換された長鎖アシル CoA は、そのままの形ではミトコンドリア内膜を通過できません。CPT1B により長鎖アシル CoA はカルニチンと結合し、長鎖アシルカルニチンとなり、この形となることで、ミトコンドリア内膜を通過し、マトリックスに移動することが可能となります(図1)。そしてミトコンドリア内で、β-酸化され、エネルギー源となります。このことから、ナルコレプシーやその他の過眠症では、長鎖アシルカルニチンの生成が抑制されていることが予測されます。
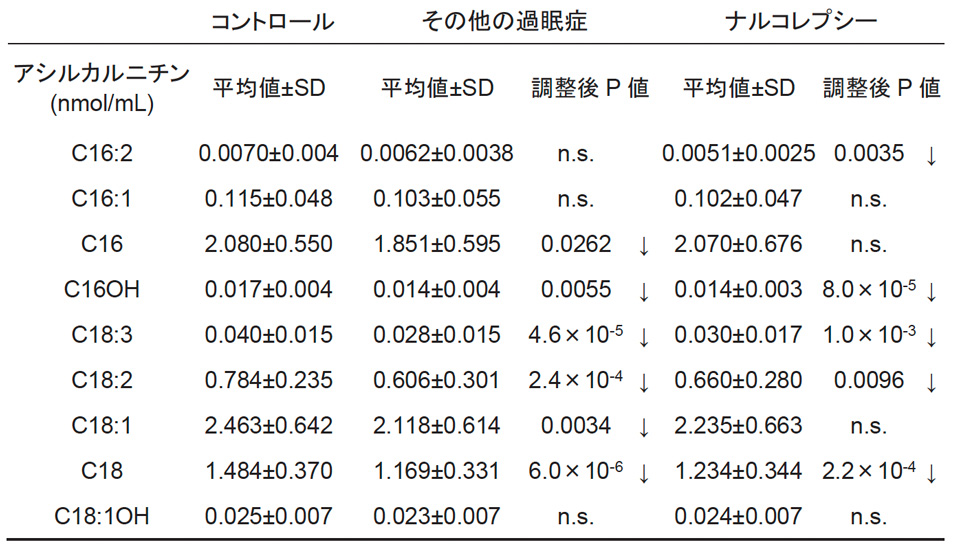
そこで本研究では、炭素鎖の長さに応じた血液中のアシルカルニチン分画を、ナルコレプシー 57 例、その他の過眠症 51 例、及びコントロールとなる健常者 61 例を対象にエレクトロスプレーイオン化タンデム質量分析法を用いて測定することで、長鎖アシルカルニチンの濃度に異常が認められるか、そして CPT1 活性が低下しているか、検証しました。炭素数(C)が 16 個から 18 個のアシルカルニチンが長鎖アシルカルニチンとなりますが、複数の長鎖アシルカルニチン濃度が、ナルコレプシー群だけでなく、その他の過眠症群において、低値を示していることを確認しました(表1)。そして、CPT1 活性を計算した結果、ナルコレプシー群、その他の過眠症群の両群において、コントロール群に比べ、CPT1 活性が有意に低いこともわかりました。
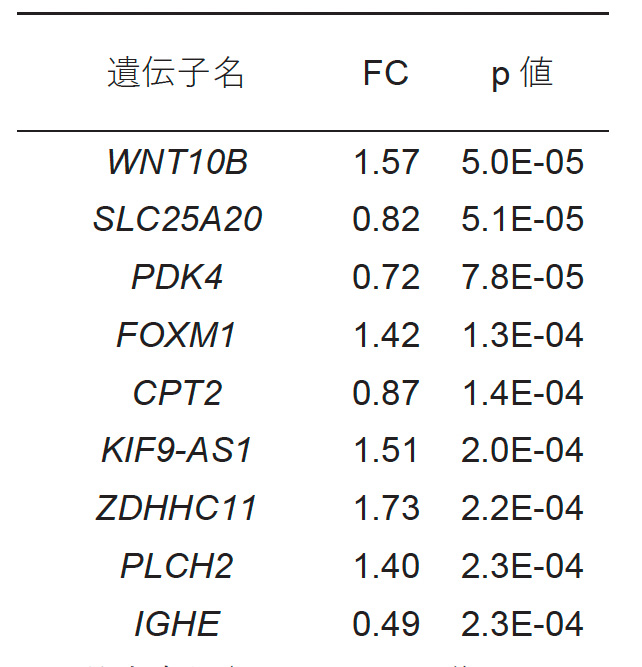
次にナルコレプシー 42 例及びコントロールとなる健常者 42 例の血液中から mRNA を抽出し、網羅的な遺伝子発現解析を行いました。その結果、カルニチンシャトルに関わる遺伝子である SLC25A20 遺伝子(CACT をコード)と CPT2 遺伝子の発現量が、ナルコレプシー群において低く、全検出遺伝子の中で、それぞれ 2 番目と 5 番目に統計学的に有意な変化を示していました。(表2)
これらの結果から、長鎖脂肪酸の代謝の機能低下がナルコレプシーやその他の過眠症の病態生理に深く関わることがわかりました。このような血液中での変化が、脳の睡眠中枢にどのように影響を与えているかを解明することが今後の課題となります。