ゲノム動態プロジェクト 主任研究員田島 陽一
がん組織は、がん細胞だけでなく、血管系、間質系、免疫系など多様な細胞集団で構成されています。がん細胞の性質や能力は、遺伝子変異や増幅、欠失などの変化だけではなく、それら周囲の様々な細胞によって影響を受けています。さらに患者の体質や生活習慣、治療などの違いが加わることで、がん細胞の生物学的特性はより複雑化しています。
私たちの体は免疫細胞(特にT細胞)によって遺伝子に傷の入ったがん細胞を排除しています。しかし、多様な特性を獲得したがん細胞の中には、免疫が本来もっている免疫ブレーキ機能(免疫チェックポイント)をうまく利用して、免疫のはたらきを抑制し、免疫やがん治療による攻撃から逃避して成長を続けます。このように免疫チェックポイント分子の発現を獲得したがん細胞の中に細胞融合が関与している可能性について我々は研究しました。
異性間骨髄移植を受けた女性患者がその数年後に膵癌を発症したケースでは、その生検内に Y 染色体を含む男性由来の核を持つ腫瘍細胞が多く検出されたという報告があります。このように腫瘍組織内ではがん細胞と間葉系幹細胞をはじめとする間質系細胞との細胞融合が起きていることが示唆されています。しかし、腫瘍組織で起きる細胞融合が、がんの性質に影響するかについては明確ではありませんでした。
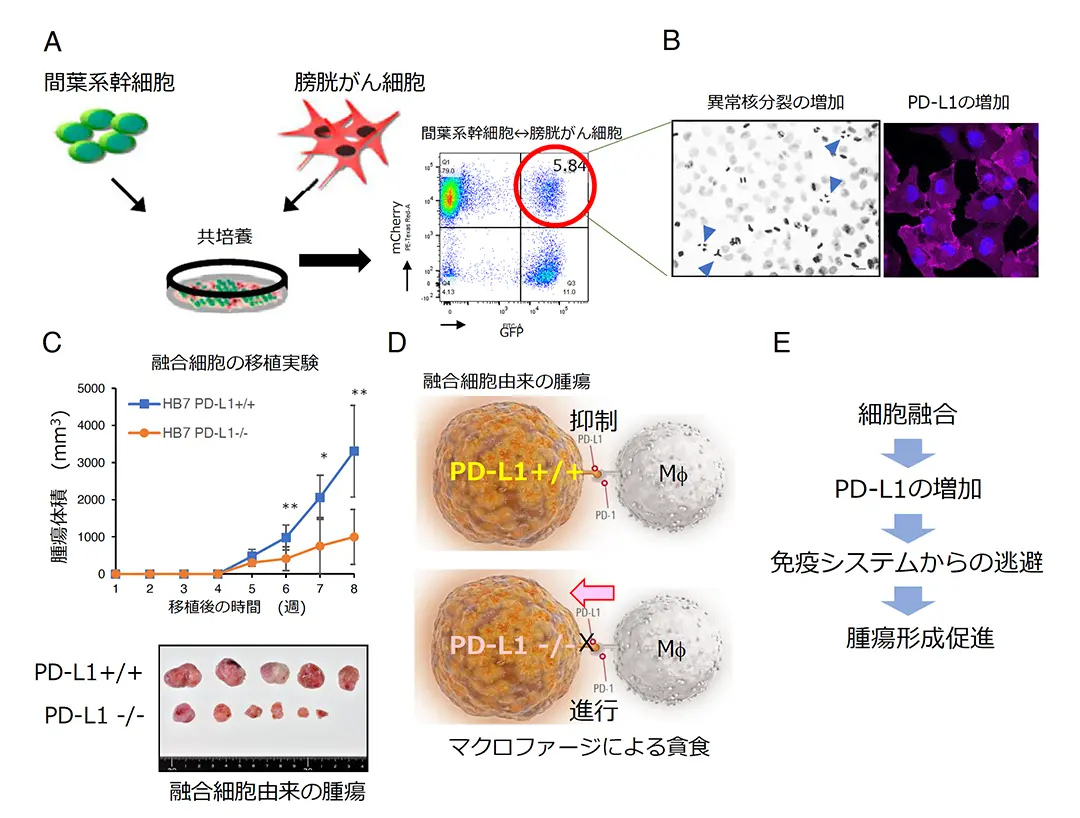
我々は、腫瘍組織内で起きる細胞融合が、がんの特徴である腫瘍の不均一性、浸潤・転移、抗がん剤耐性などの悪性化に重要であるという仮説を立てました。我々は膀胱がん細胞(UMUC-3)と間葉系幹細胞(BM-MSC)の共生培養を行い、約 5%の細胞が細胞融合することを見出しました(図A)。融合細胞では有糸分裂異常が頻繁に起こり(図B)、その結果ゲノム不安定性を示しました。さらに融合細胞では免疫チェックポイント分子の一つである PD-L1の発現が顕著に増加していました(図B)。異種移植実験において、融合細胞は休眠期間を経て、元の膀胱がん細胞(UMUC-3)と同様に効率よく腫瘍を発生させました。人為的に PD-L1 をノックアウトした(PD-L1-/-)融合細胞は PD-L1+/+ の融合細胞よりも腫瘍形成が減弱することを見出しました(図C)。PD-L1-/- の腫瘍組織内ではPD-1 を発現するマクロファージが多数浸潤し、がん組織の壊死が観察されましたが、PD-L1+/+ の腫瘍組織内ではほとんど見られませんでした。PD-L1+/+ の融合細胞はマクロファージの PD-1 と結合するとマクロファージの貪食を抑制すると考えられます。一方、PD-L1-/- 融合細胞はマクロファージの貪食が進行し腫瘍が退縮すると考えられます(図D)。以上をまとめると、がん細胞と間葉系幹細胞が細胞融合を起こすと融合細胞は PD-L1 を増加させ、PD-1 を発現するマクロファージなどの免疫細胞の攻撃を無効化することで、腫瘍形成を促進すると考えられます。また、がん細胞は体細胞と細胞融合を行うことで免疫細胞からの攻撃を保護していると考えられます(図E)。
今回の研究成果により、腫瘍組織では稀にがん細胞と体細胞の細胞融合が起き、そのことががんの悪性化につながることを示しました。がん細胞と間葉系幹細胞との相互作用については不明な点が多かったのですが、細胞融合が免疫細胞の攻撃から保護し、腫瘍形成を促進させる役割を持つことが明らかになりました。臨床的には免疫チェックポイント阻害薬が適用できない PD-L1 陰性の腫瘍を間葉系幹細胞と細胞融合させることで PD-L1 陽性に変化させ、免疫チェックポイント阻害薬が効率的な腫瘍に改変することが期待されます。さらに、細胞融合を阻害する方法が開発できれば新たな癌治療に繋がることが期待されます。