人流の拡大や気象変動に伴い、病原ウイルスによるパンデミックのリスクが近年高まっていると言えます。 2019年末に発生した新型コロナの流行初期に求められたのは、感染しにくい体をつくる「予防ワクチン」に加えて、感染した際にウイルスの増殖やそれに伴う炎症を抑制し、重症化を防ぐ「治療薬」の迅速な開発でした。米国ギリアド社をはじめとする製薬会社が開発に着手し、半年後の2020年5月に抗エボラウイルス薬として開発が進められていたレムデシビルが新型コロナウイルス治療薬として承認された一方、国産の抗ウイルス薬ゾコーバが承認されたのは2022年11月でした。今後発生する新たなウイルス感染症に対して迅速に対応するために私たち研究者ができることは、①様々なウイルスの性状解析や抗ウイルス薬を探索するための研究プラットフォームを構築すること、②それを用いてウイルス感染の分子機構を解明すること、③多様な病原ウイルスに対して有効な抗ウイルス薬やワクチン候補を開発することが挙げられます。
免疫制御ユニットでは、これまでに進めてきた重点感染症に対する予防ワクチン開発に加えて、新型のウイルス感染症に有効性を発揮する治療薬の開発に繫がる基礎研究を推進します。ウイルスの増殖を効果的に抑え込むための創薬標的を見極めるには、ウイルスがどのように細胞に感染し、細胞機能をハイジャックすることで子孫を増やしていくのかを分子レベルで理解する必要があります。そのような研究を進めるためには、ウイルスが感染・増殖できる培養細胞や感染モデル動物が必要となることから、ウイルスの培養が困難な場合には研究を進める上で大きな障壁となります。実際、新型コロナウイルス研究ではウイルス研究に広く使用されているVero細胞(アフリカミドリザル由来)は感染効率が十分ではなかったため、ウイルスが侵入に使うヒト由来因子TMPRSS2を発現した改変Vero細胞が研究に多用されました。
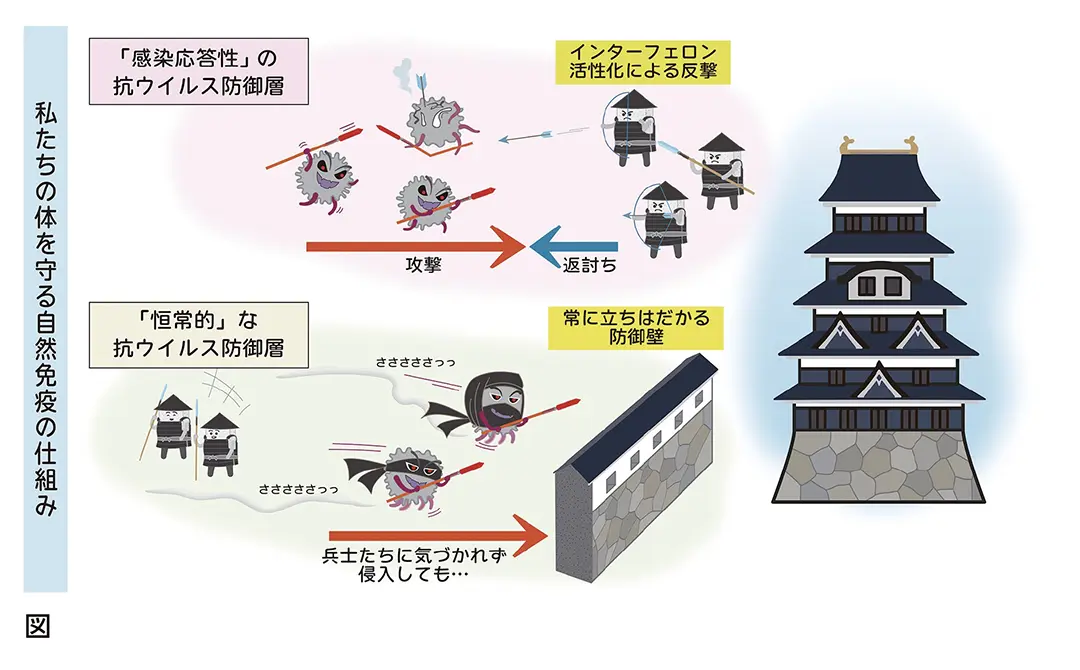
ウイルス培養に用いる細胞には、侵入因子以外にもウイルス感染効率を規定する抗ウイルス因子が多数存在します。抗ウイルスシグナル伝達機構については不明な点が多く残されていますが、私たちの体には「インターフェロン制御因子」と呼ばれる強力な抗ウイルス応答の制御スイッチがいくつも存在していることが知られています。これらを起点とするウイルス抑制機構を解明することで、効率的なウイルス培養法の開発に繫がるだけでなく、ウイルスを排除する戦略としても応用できる可能性を秘めています。このように私たちの体が生まれつき持っている感染防御の仕組みを「自然免疫」と呼びますが、この自然免疫によるウイルス抑制作用を研究し、解明することで、強力な免疫作用を模倣する治療薬の開発を目指します。
私たちはこれまでの研究成果として、自然免疫がウイルス複製を抑制する仕組みの詳細を明らかにしてきました。ウイルス培養の障壁となる抗ウイルスシグナル伝達経路として、ウイルス感染に応答して発動する既知の「応答性シグナル」だけでは説明のつかない現象が存在することを突き止め、恒常的に機能している抑制シグナルの存在を明らかにしました。この「恒常的な防御層」は、多くの病原ウイルスに対する強力な感染抑制機能をもつことから、この機能をノックアウトすることにより、新たな研究基盤となるウイルス培養システムを構築することに成功しました。さらに、この抗ウイルス防御層が機能する仕組みから着想を得た、新規の抗ウイルス薬候補を見出しています。このように、私たちの体のもつ自然免疫の仕組みを詳細に紐解くことで、幅広い病原ウイルスに有効性を発揮する新たな治療薬の開発へと繫げていきます。(図)。
当ユニットの前身となるウイルス感染プロジェクト時代より、今後のパンデミックに備えるべき「重点感染症」に指定されている手足口病ウイルスに対する予防ワクチンの開発を進めています。当ユニットではこれまでに手足口病ウイルスの侵入受容体を同定し、それを発現するヒト化マウスを作製することで、病態解析を可能とする感染動物モデルを確立しました。私たちが確立したこのマウスモデルを用いて新規ワクチン候補の評価を行うことで、実用化を見据えた高い有効性をもつワクチンの開発を進めていきます。