HOME > 広報活動 > 刊行物 > January 2013 No.008

January 2013 No.008
特集
研究紹介
開催報告・コラム
研究紹介
難病ALSや若年性認知症の患者に蓄積する異常TDP-43の解析、病態を解明
~治療法開発に期待~
英国科学雑誌「Brain(ブレイン)」に認知症・高次脳機能分野の長谷川成人参事研究員らの研究成果が発表されました。
認知症・高次脳機能研究分野長谷川 成人
筋萎縮性側索硬化症(ALS)は運動ニューロンの変性により筋肉の萎縮と筋力低下をきたす神経難病です。また前頭葉頭様変性症(FTLD)は、前頭葉や側頭葉が強く変性、萎縮する認知症の総称です。孤発性ALSの大多数とFTLDの約半数には、核タンパク質の一種であるTDP-43 (TAR DNA binding protein of 43kDa)の異常病変が認められ、TDP-43病変の分布や広がりと臨床症状の密接な関係が示されています。また家族性、孤発性ALS患者にTDP-43遺伝子の変異が同定されたことから、TDP-43の異常病変は発症や進行の原因と考えられています。
TDP-43の病変はその分布や形態的特徴からいくつかのタイプに病型が分類されており、FTLDはその中のタイプA、 B、 Cの3種に、ALSはその中のタイプBに分類されます。私達はTDP-43の異常構造の違いが病型を決定している可能性があると考え、それぞれのタイプの患者剖検脳を生化学的に解析しました。その結果、病気のタイプに一致して、蓄積するTDP-43の電気泳動のリン酸化バンドパターン、及びプロテアーゼ耐性(プリオンの判定などに用いられる性質で、タンパク質が特殊な構造をとっている事を意味します)を示すバンドが異なることが判明しました。この結果は、蓄積するTDP-43は生化学的に区別することができ、少なくとも3種類の異なる異常構造をとって蓄積することを示しています。また、一人の患者では脳のどの部位においても同じバンドパターンを示し、同一の異常構造のTDP-43が蓄積していることが明らかになりました。このように複数の構造をとりうるにも関わらず、異なる部位の異なる細胞で同じものが蓄積していることは、最初に出現した異常TDP-43が細胞間を伝わりながら広がって同じ病変を形成したことを強く示唆します。私達は細胞内に生じた異常タンパク分子がプリオンのように細胞間を広がることで病気が進行するという新しい仮説を提唱していますが、今回の結果は、実際の患者脳においてこの仮説が正しいことを支持するものです。今後、異常TDP-43が脳や脊髄全体に広がるプロセスの解明やそれを抑える低分子化合物、抗体等の開発を進め、これら難病の根本治療につなげたいと考えています。
Hiroshi Tsuji, Tetsuaki Arai, Fuyuki Kametani, Takashi Nonaka, Makiko Yamashita, Masami Suzukake, Masato Hosokawa, Mari Yoshida, Hiroyuki Hatsuta, Masaki Takao, Yuko Saito, Shigeo Murayama, Haruhiko Akiyama, Masato Hasegawa, David M. A. Mann and Akira Tamaoka
Brain (2012) doi: 10.1093/brain/aws230
First published online: October 3, 2012
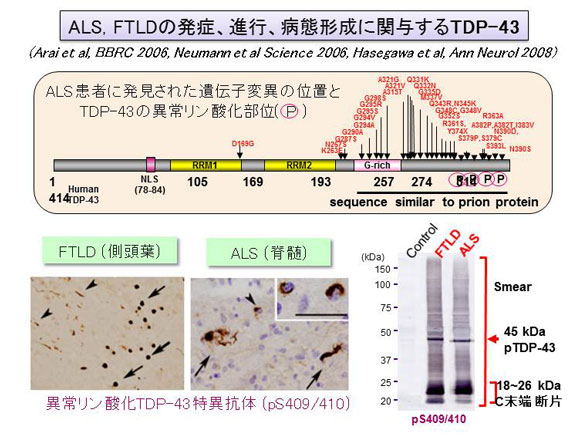
<図1>
TDP-43の模式図、遺伝子変異、リン酸化部位、及びその組織病理と生化学 TDP-43は414アミノ酸からなる核タンパク質。中央部に二つのRNA認識配列(RRM)、C末端側にグリシンに富んだ領域を有する。患者脳に蓄積するTDP-43はC末端側が異常リン酸化されている。左下図は異常リン酸化部位(pS409/410)に対する抗体による免疫組織染色, 右下図は生化学解析を示す。
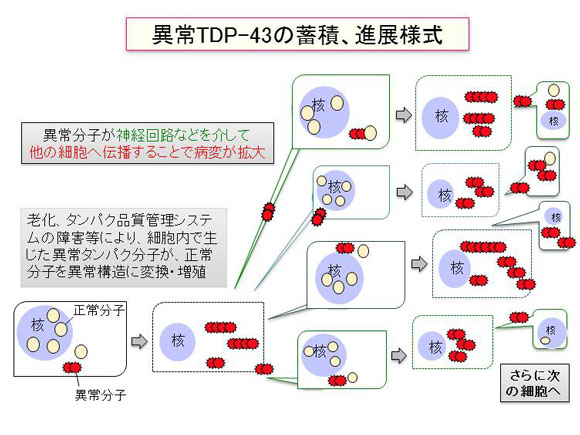
<図2> TDP-43の蓄積、進展様式の仮説を示す模式図
細胞内で生じた異常タンパク分子が、プリオン様の特性から自身を鋳型にして正常分子を異常構造に変換、増殖し、神経回路などを介して細胞間を広がることにより病気が進行するという仮説。

