2026年2月19日
感染症医学研究センターの小林郷介主席研究員らの研究グループは共同研究により、「サフォルドウイルスの受容体を発見〜小児の脳炎や髄膜炎も懸念されるサフォルドウイルス感染の「入口」を世界で初めて解明〜」について Nature Communications に発表しました。
サフォルドウイルスの受容体を発見
〜小児の脳炎や髄膜炎も懸念されるサフォルドウイルス感染の「入口」を世界で初めて解明〜
【ポイント】
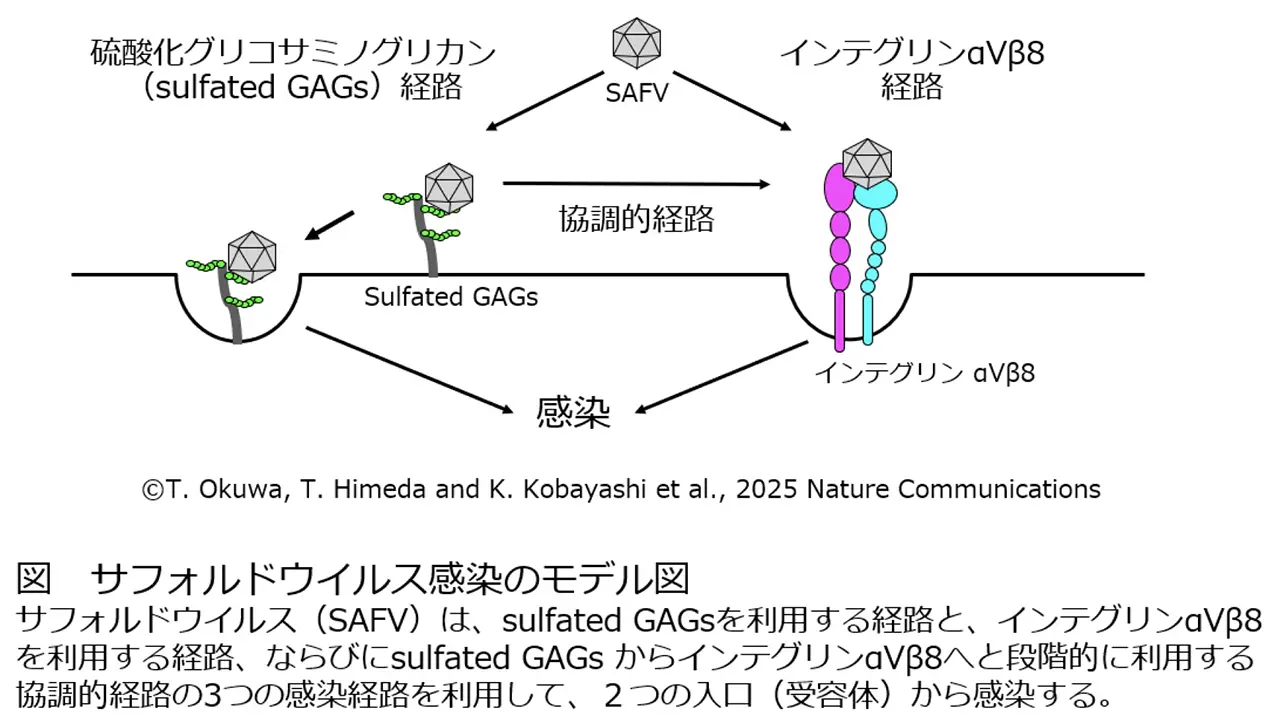
- ① サフォルドウイルス(SAFV)(注1)の 2つの感染受容体(注2)として「硫酸化グリコサミノグリカン(sulfated GAGs)(注3)」と「インテグリン(注4) αVβ8」を世界で初めて同定しました。
- ② SAFV は、これら 2つの受容体を単独または段階的(協調的)に利用する複数の感染経路をもつことが明らかになりました。
- ③ 感染の最初のステップが解明されたことで、SAFV がどのように病気を引き起こすのかというメカニズムの理解が進み、将来的には SAFV と受容体の結合を阻害する薬剤の開発などを通して、広くウイルス感染の予防・治療に貢献することが期待されます。
発表論文
- <論文タイトル>
- “Saffold Virus Exploits Integrin αVβ8 and Sulfated Glycosaminoglycans as Cooperative Attachment Receptors for Infection”
- <著者>
- Takako Okuwa*, Toshiki Himeda*, **, Kyousuke Kobayashi*, Namiko Nomura, Kouichi Utani, Satoshi Koike, Akira Nakamura, Masaya Higuchi**(*共同筆頭著者、** 共同責任著者)
- <発表雑誌>
- Nature Communications
DOI:10.1038/s41467-025-67236-z
URL:https://doi.org/10.1038/s41467-025-67236-z
研究の概要
金沢医科大学医学部微生物学講座の大桑孝子助教、姫田敏樹准教授および樋口雅也教授らの研究グループは、当研究所 感染症医学研究センターの小林郷介主席研究員らの研究グループとの共同研究により、硫酸化グリコサミノグリカン(sulfated GAGs)とインテグリンαV β8 が、主に小児の急性呼吸器疾患や胃腸炎の原因となるウイルスで、脳炎や髄膜炎などの重篤な神経疾患との関連も指摘されているサフォルドウイルス(SAFV)の受容体であることを発見しました。さらに、SAFV が、(1) sulfated GAGs を利用する経路、(2) インテグリンαVβ8 を利用する経路、(3) sulfated GAGs → インテグリンαVβ8 と段階的に利用する協調的経路、という 3つの感染経路を持つことを明らかにしました。また、複数の臨床分離株で同様の感染様式が確認され、これらの経路が遺伝子型を問わず SAFV に共通する感染機構であることが示されました。
本成果は、SAFV 感染の最初のステップを解明したものであり、SAFV の病原性研究の基礎的知見となるとともに、将来的に広くウイルス感染の予防・治療に貢献することが期待されます。
なお、本研究成果は、英国時間 2025 年 12 月 15 日に Springer Nature(Nature Portfolio)のオープンアクセス電子ジャーナルNature Communicationsに掲載されました。
研究の背景
SAFV は、ピコルナウイルス科カルジオウイルス属に属し、2007 年にヒトから初めて分離されました。1~11 型の遺伝子型が報告されており、特に 2 型、3 型(SAFV-2、-3)は世界各地で検出されています。主に小児の急性呼吸器疾患や胃腸炎、手足口病の原因となるウイルスで、重症化した場合には脳炎や髄膜炎、急性弛緩性麻痺などの重篤な神経疾患を引き起こすことが報告されています。
ウイルスの病原性や臓器指向性は、どの受容体に結合できるかによって大きく左右されます。しかし、SAFV の感染機構、特に「どの受容体を使って細胞へ侵入しているのか」という感染の最初のステップが解明されていませんでした。このことが病原性の理解に大きな障壁となっていました。
研究の成果
本研究グループは、SAFV の未知の受容体を同定するため、細胞内の全遺伝子を対象とした網羅的解析手法であるゲノムワイド CRISPR-Cas9 ノックアウトスクリーニング(注5)を実施しました。感染経路が2つあるウイルスの場合には、片方が欠損(ノックアウト)しても、もう片方から感染してしまうため、一度のスクリーニングだけでは正しい候補をすべて見つけることはできないと考え、スクリーニングを二段階で行ないました。一次スクリーニングでは SAFV の感染に重要な宿主因子として SLC35B2(sulfated GAGs の合成に必須)が同定されました。次いでSLC35B2 欠損細胞を用いた二次スクリーニングによって、一次スクリーニングでは一貫して同定されなかったインテグリン αVβ8 を同定することに成功しました。それぞれを単独で欠損させた細胞では感染効率が低下しましたが、感染は完全には阻止されませんでした。一方で、両方を欠損させた場合には感染が完全に阻止されました。このことから、SAFV が sulfated GAGs を利用する経路と、インテグリン αVβ8 を利用する経路の 2 つの経路から感染することが示されました。
さらに、SAFV のウイルス粒子がヘパリン(sulfated GAGs の一種)およびインテグリン αVβ8の双方に直接結合することが確認され、これらの分子が実際に受容体として機能していることが裏付けられました。また、これらの受容体を介した感染には、(1) sulfated GAGs を利用する経路、(2) インテグリン αVβ8 を利用する経路に加えて、(3) SAFV がまず sulfated GAGs によって細胞の表面に結合し、その後インテグリン αVβ8 を利用して細胞内へ侵入するという経路もあることが実験的に示されました。両受容体が並行かつ協調的にウイルスの細胞侵入に介在する感染機構は SAFV-2 および SAFV-3 の複数の臨床分離株でも共通して観察され、SAFV に広く保存された仕組みであることが明らかになりました。
効果・今後の展開
SAFV の感染の入口となる受容体が明らかとなり、どの細胞が SAFV に感染しやすいのか、なぜ神経症状を引き起こすのかといった病原性発現機構の理解が大きく進むと考えられます。
将来的には、SAFV と受容体の結合を阻害する薬剤の開発や、複数の感染経路を同時に阻害する感染防止戦略の確立を通して、広くウイルス感染の予防・治療に貢献することが期待されます。
<研究費情報>
本研究は、日本学術振興会 科学研究費助成事業(JSPS KAKENHI)(基盤研究(C);21K07045、 24K10234、25K10386)、日本医療研究開発機構(AMED)(新興・再興感染症に対する革新的医薬品等開発推進研究事業「ポリオウイルスを含むエンテロウイルス感染症の包括的な解明および総合的な公衆衛生対策に資する研究」)、金沢医科大学奨励研究(S2023-4)、金沢医科大学アシスト KAKEN(K2024-3)、および株式会社ヤクルト本社からの助成を受けて行われました。
<用語解説>
- 注1)サフォルドウイルス (SAFV, Saffold Virus):
- ピコルナウイルス科カルジオウイルス属に分類されるウイルス。主に小児に感染し急性呼吸器疾患や胃腸炎、手足口病を引き起こす他、髄膜炎や脳炎など神経疾患との関連が報告されている。
- 注2)受容体:
- 細胞表面にある、特定の物質(この場合はウイルス)を認識して結合する分子。ウイルス感染では、ウイルスが細胞内へ入るための「入口」の役割を果たす。
- 注3)硫酸化グリコサミノグリカン (Sulfated Glycosaminoglycans, Sulfated GAGs):
- 細胞表面に存在する糖鎖の一種。負の電荷を持つ硫酸基が結合しており、ヘパラン硫酸(HS)などが代表的。多くのウイルスが付着分子として利用することが知られている。
- 注4)インテグリン(Integrin)
- 細胞表面に存在する膜タンパク質。細胞の接着や細胞内シグナル伝達に関わり、αとβの2つのサブユニットが結合した複合体(組み合わせは24種類ある)として機能する。本研究ではインテグリンαVβ8がSAFVの受容体として同定された。
- 注5)ゲノムワイドCRISPR-Cas9ノックアウトスクリーニング:
- ゲノム編集技術であるCRISPR-Cas9を用いて、細胞の遺伝子を一つ一つ破壊し(ノックアウト)、表現型の変化を解析することで、特定の生物学的過程や細胞機能に関与する宿主遺伝子を網羅的に同定する手法。
<研究体制>
本研究は、金沢医科大学 医学部 微生物学講座(樋口雅也教授、姫田敏樹准教授、大桑孝子助教、宇谷公一助教)と、東京都医学総合研究所 感染症医学研究センター(小林郷介主席研究員、小池智研究員)、同研究所ウイルス感染プロジェクト(当時)(野村奈美子技術員(当時))、東北医科薬科大学 医学部 免疫学教室(中村晃教授(当時。現・名誉教授))との共同研究として実施されました。
