2026年1月14日
カルパイングループの野口あや研究員(現・脳神経回路形成プロジェクト)、秦勝志主席研究員(グループリーダー)、小野弥子前リーダーらは、「カルパイン15はユビキチン化タンパク質を標的とするプロテアーゼであり、E-カドヘリンを切断することで細胞接着を制御する」について、米国科学雑誌Journal of Biological Chemistry に発表しました。
先天性奇形症候群の発症に関わる酵素「カルパイン15」が、
細胞同士の接着を調節する役割を担うことを発見
当研究所カルパイングループの野口あや研究員(現・脳神経回路形成プロジェクト)、秦勝志主席研究員(グループリーダー)、小野弥子前リーダー(現・埼玉医科大学准教授)は、当研究所基盤技術支援センター遺伝子改変動物室の設樂浩志室長、東京大学医科学研究所の佐伯泰教授、順天堂大学の土屋光准教授と共同で、細胞内タンパク質分解酵素であるカルパイン15(CAPN15)が、ユビキチン修飾されたタンパク質を標的とする特性を持ち、細胞同士をつなぐ接着分子「E-カドヘリン」を制御することを明らかにしました。
近年、CAPN15の異常は先天性奇形症候群の原因となることが報告されており、本研究成果はその発症メカニズムの理解につながることが期待されます。本研究成果は、米国科学雑誌 Journal of Biological Chemistry にオンライン掲載されました。
発表論文
- <論文タイトル>
- “CAPN15 is a non-proteasomal, ubiquitin-directed calpain protease that regulates cell adhesion by cleaving E-cadherin”
(カルパイン15 はユビキチン化タンパク質を標的とするプロテアーゼであり、E- カドヘリンを切断することで細胞接着を制御する) - <発表雑誌>
- Journal of Biological Chemistry
DOI:10.1016/j.jbc.2025.111034
URL:https://doi.org/10.1016/j.jbc.2025.111034
研究の背景
カルパイン15(CAPN15)は、細胞内で働く「カルパイン」と呼ばれるタンパク質分解酵素群の仲間です。CAPN15はその中で唯一、ユビキチン(細胞内でタンパク質の分解や機能調節の目印(タグ)となる分子)を認識する性質を持つことが知られていましたが、その生理的な役割は長らく不明でした。一方、近年になって、CAPN15の機能喪失が先天性奇形症候群「Oculogastrointestinal neurodevelopmental syndrome (OGIN)」を引き起こすことが報告され、発生や組織形態維持との関連が注目されるようになりました。
発表の内容
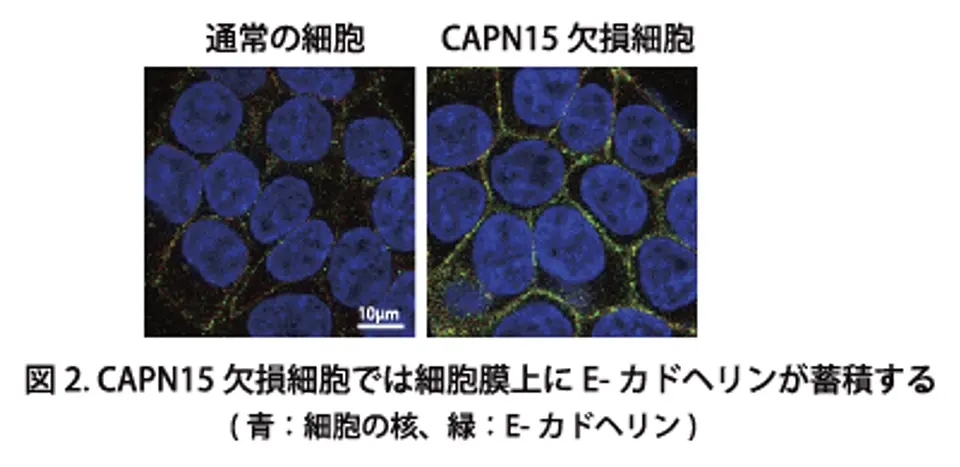
本研究では、上皮系培養細胞を用いてCAPN15の機能解析を行いました。CAPN15を欠損させた細胞では、通常よりも細胞同士が過剰に密集する異常な状態が観察されました(図1)。この原因を明らかにするため、CAPN15が標的とするタンパク質を探索した結果、細胞接着分子であるE-カドヘリンを同定しました。E-カドヘリンは細胞膜に存在し、細胞同士を結びつける中心的な役割を担っています。
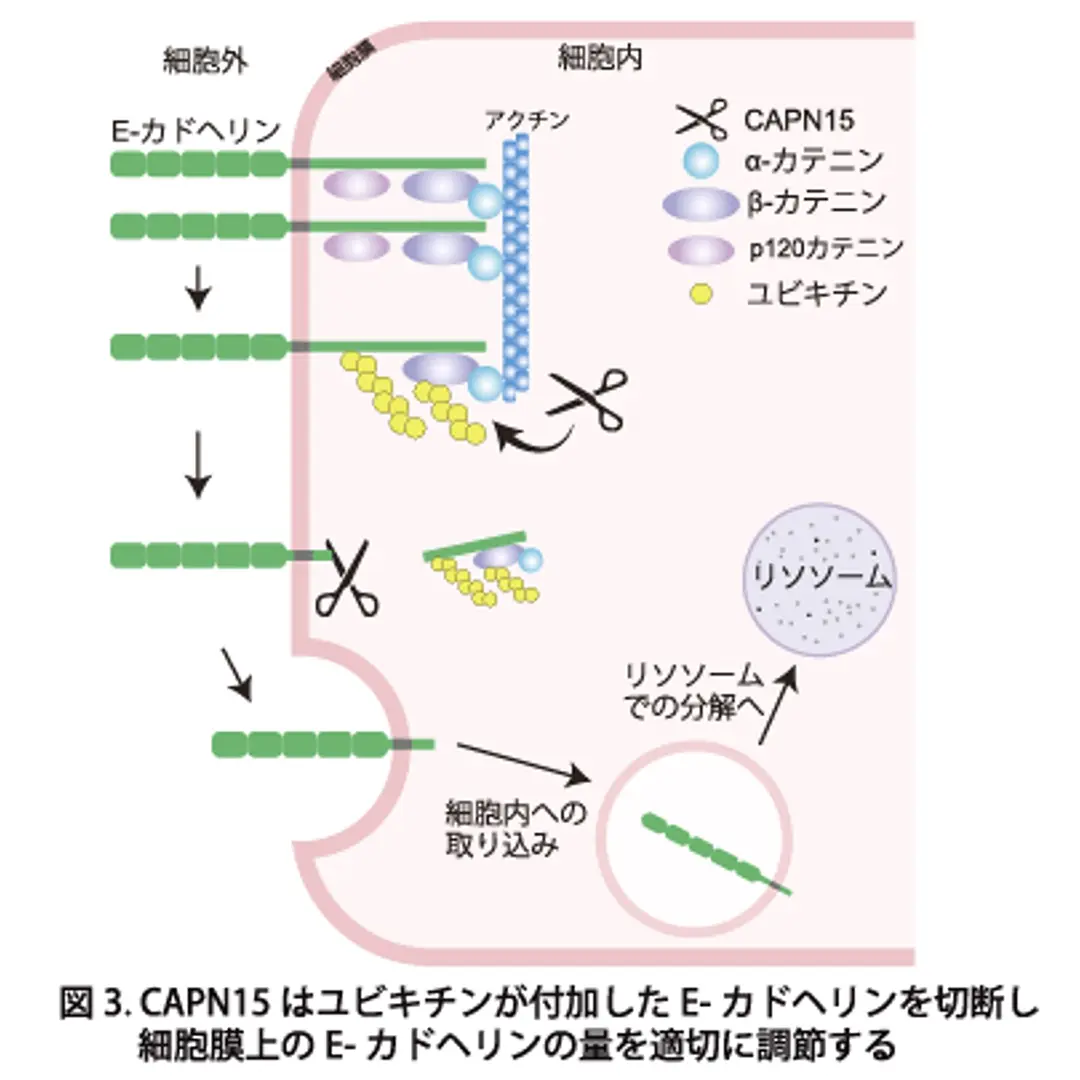
本研究により、CAPN15は特定の条件下でユビキチンが付加されたE-カドヘリンを認識し切断することで、細胞膜上のE-カドヘリン量を適切に調節していることが明らかになりました。CAPN15に異常が生じると、この調節がうまく働かなくなり、E-カドヘリンが細胞膜上に過剰に蓄積するため、細胞が過度に密集すると考えられます(図2および3)。さらに、CAPN15欠損マウスの上皮組織においてもE-カドヘリンの蓄積が認められ、培養細胞で観察された現象が生体内で再現することが確認されました。
研究の意義・今後の展望
本研究により、CAPN15がユビキチンを目印として特定のタンパク質を切断する、非常に特徴的な酵素であることが明らかになりました。ユビキチン修飾を認識して標的タンパク質を切断する酵素はほとんど知られておらず、本研究は細胞内でのタンパク質制御の仕組みに新たな視点をもたらすものです。
私たちの体の臓器や組織は、細胞同士が適切に接着することで形や機能を維持しています。その中心的な役割を担うE-カドヘリンの量や働きが乱れると、発生の異常や組織構造の乱れにつながります。本研究は、CAPN15がE-カドヘリンを調節することで上皮組織の安定した構造を支えていることを、細胞レベルと生体レベルの両方で示しました。
また、CAPN15異常に起因する先天性奇形症候群OGINについても、本研究成果はその発症メカニズムを理解するための重要な手がかりを提供します。今後、発生異常や組織形成の研究、さらには疾患の病態解明へと発展することが期待されます。
研究助成
本研究は、日本学術振興会科学研究費補助金(JP23K14508, JP24K01981, JP23H05479, JP22K06156, JP23K06126)、上原記念生命科学財団、武田科学振興財団の支援を受けて行われました。