2026年1月5日
蛋白質代謝研究室の吉田雪子室長・遠藤彬則主席研究員、研究技術開発室の西藤泰昌主席基盤技術研究職員、認知症研究プロジェクトの長谷川成人副所長・亀谷富由樹研究員らは「転写因子Nrf1によるプロテアソーム活性維持機構〜糖鎖脱離に伴うアミノ酸配列編集〜」についてPNAS に発表しました。
転写因子Nrf1によるプロテアソーム活性維持機構
〜糖鎖脱離に伴うアミノ酸配列編集〜
蛋白質代謝研究室の吉田雪子室長・遠藤彬則主席研究員、研究技術開発室の西藤泰昌主席基盤技術研究職員、認知症研究プロジェクトの長谷川成人副所長・亀谷富由樹研究員らは、生命の維持に必須なタンパク質分解装置プロテアソームの活性を維持する機構について明らかにしました。
この研究成果は2025年12月30日(火)に米国科学誌「Proceedings of the National Academy of Science of the United States of America (PNAS)」のオンライン版に掲載されました。
発表論文
- <論文タイトル>
- “NFE2L1/Nrf1 forms a coactivator complex post-peptide:N-glycanase-mediated sequence editing and mitigates proteasome dysfunction”
(NFE2L1/Nrf1はペプチドNグリカナーゼによる配列編集により活性型複合体を形成し、プロテアソーム機能不全を回復させる) - <発表雑誌>
- Proceedings of the National Academy of Science of the United States of America (PNAS)
DOI:10.1073/pnas.2517547123
URL:https://www.pnas.org/doi/10.1073/pnas.2517547123
発表のポイント
- 生命の維持に必須なタンパク質分解装置プロテアソーム(注1)の発現調節を行う転写因子Nrf1(注2)の活性化機構を明らかにしました。
- 糖タンパク質から糖鎖を取り除く酵素NGLY1によるNrf1のアミノ酸配列の変換(注3)が、Nrf1が染色体上で転写因子として機能するための複合体形成を可能にすることを示しました。
- Nrf1が常に活性化していると細胞死を引き起こすことから、プロテアソーム活性が低下した時にのみNrf1が働くことの必然性を明らかにしました。
社会的意義
プロテアソームの活性低下は、加齢に伴う神経変性疾患に関与していることが知られています。そのため、プロテアソーム活性化の分子機構を解明することは極めて重要です。
プロテアソームの機能障害時に、その活性を回復させるNrf1がどのように新たなプロテアソームの合成を促すかを理解することは、プロテアソームの機能障害に関連する疾患に対する新たな治療戦略につながる可能性が考えられます。
研究の背景
細胞内のほとんどのタンパク質は、プロテアソームにより寿命が厳密に制御されています。プロテアソームは、役割を終えたタンパク質だけではなく、損傷したタンパク質や立体構造に異常をきたしたタンパク質を分解し、細胞内から迅速に取り除きます。この仕組みは細胞の恒常性維持に不可欠であり、プロテアソームの働きが衰えると、異常なタンパク質が細胞に蓄積してしまいます。この異常タンパク質の蓄積こそが、老化や神経変性疾患の主要な特徴の一つです。したがって、プロテアソーム活性を正常に保つことは、私たちの健康を維持する上で極めて大切です。
プロテアソームは33種類・66個のサブユニットから構成されますが、これらすべての遺伝子発現を誘導するのが転写因子Nrf1です。しかし、Nrf1は小胞体(注4)で合成された直後からにプロテアソームにより分解される短寿命の糖タンパク質であり、通常は核に到達して転写を行うことはできません。プロテアソーム活性が減弱した時にのみ、Nrf1は分解を免れて核に移行し、プロテアソーム遺伝子の発現を誘導します。さらに、Nrf1が転写活性をもつためには、タンパク質切断酵素DDI2と糖鎖脱離酵素NGLY1の作用が重要であることが報告されていました。
また、昨年ノーベル医学・生理学賞を受賞したGary Ruvkunらは線虫の遺伝学を用いて、NGLY1による糖鎖の除去と同時に起こる糖鎖付加アスパラギンのアスパラギン酸へのアミノ酸編集がNrf1の転写活性に重要であることを報告しました。
私たちはこれまでNGLY1欠損症の研究を通じ、NGLY1がない場合に、Nrf1が不活性化される仕組みを明らかにしてきました。今回は、NGLY1によるアミノ酸編集がどのようにNrf1のプロテアソーム転写誘導に必須なのかを解明しました。
研究の内容
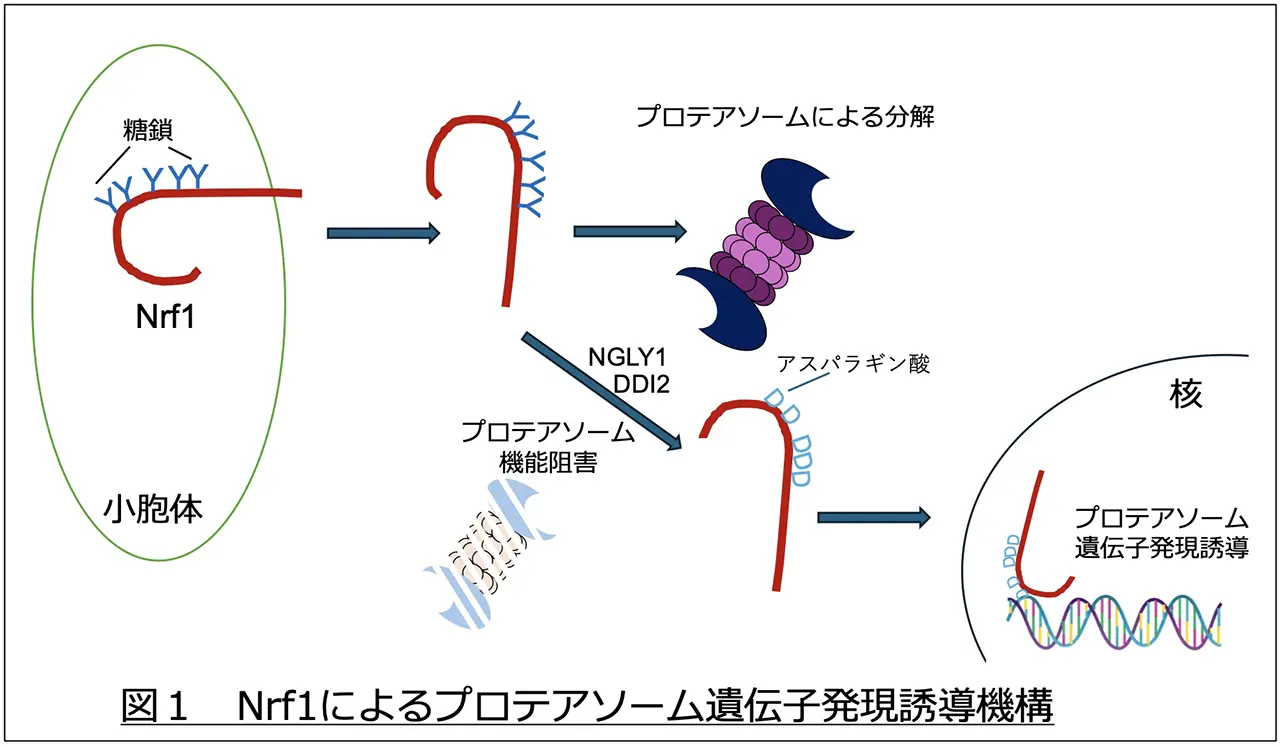
Nrf1は細胞で生合成されるとすぐにプロテアソームにより分解される短寿命タンパク質です。しかし、プロテアソーム活性が低下すると分解を免れ、核に移行してプロテアソーム遺伝子の発現を誘導し、新しいプロテアソームを生成させます。Nrf1は糖タンパク質であり、NGLY1による糖鎖の脱離に伴うアミノ酸編集がNrf1のプロテアソームの発現増加に必要であるということが近年示されていました(図1)。
本研究では、Nrf1のアミノ酸編集に伴い転写誘導が起こる遺伝子群の全貌を明らかとすると共に、NGLY1によるNrf1のアミノ酸編集がどのようにプロテアソーム構成成分の発現誘導に必要であるのか、その分子機構を明らかとしました。
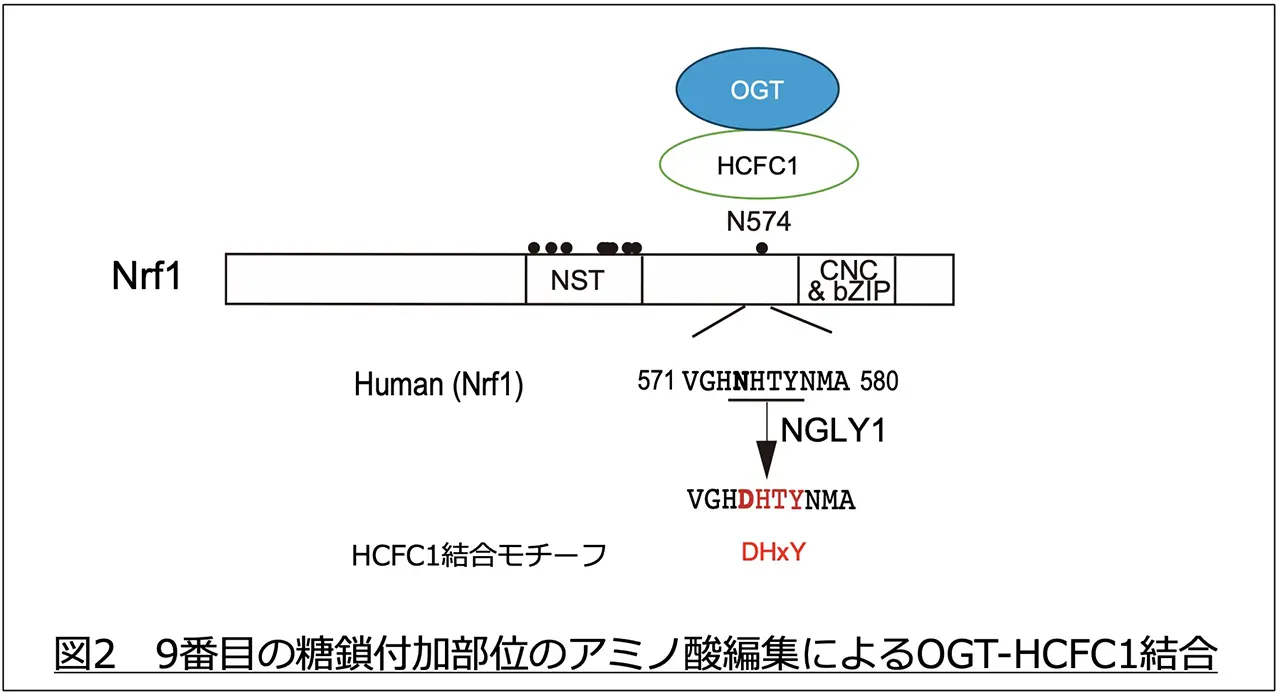
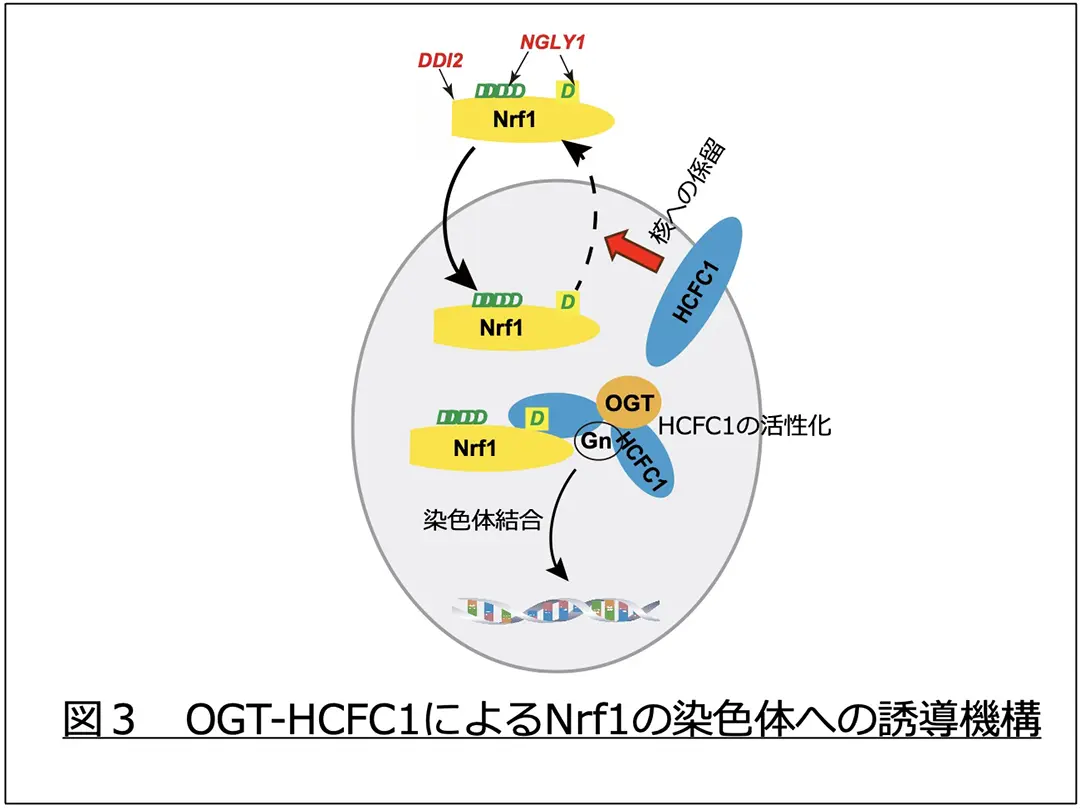
Nrf1は小胞体で合成される際に9ヶ所の糖鎖修飾を受け、細胞質においてNGLY1により9ヶ所すべてのアミノ酸が変換されます。これらアミノ酸編集が起こらないと、プロテアソーム遺伝子の転写誘導は起こりません。特に9番目の糖鎖付加部位のアミノ酸編集が最重要であることが分かりました。プロテアソーム活性が低下するとDDI2によりN末側のペプチドが切断され、核に輸送されます。しかし、編集を受けていない場合、核から細胞質へ戻ってきてしまうことを見出しました。NGLY1による9番目のアミノ酸編集が核タンパク質HCFC1(注5)との結合配列を作りだし、HCFC1と結合することでNrf1は核に保持されることが分かりました(図2)。また、HCFC1はOGT(注5)と2量体を形成しており、OGTがHCFC1にN−アセチルグルコサミン(GlcNAc)を付加すると同時に切断することでHCFC1を活性化します。9番目のアミノ酸編集によるOGT-HCFC1の結合が、Nrf1が染色体へ運ばれるために必要であることを明らかとしました(図3)。また、Nrf1の他の部位のアミノ酸編集は、染色体に結合したNrf1と転写活性化タンパク質として知られるp300/CBPとの結合に必要であることも判明しました(図4)。
これらの知見を踏まえ、DDI2による切断とNGLY1によるアミノ酸編集を模した恒常的活性化型Nrf1を細胞で発現させたところ、プロテアソームの活性上昇だけでなく、細胞死が誘導されることがわかりました。アミノ酸編集を受けたNrf1はプロテアソーム構成因子だけでなく、抗ストレス因子やオートファジーに関わる因子、抗炎症因子や炎症性サイトカインなど多様な遺伝子も誘導します。これらのことから、Nrf1はプロテアソーム活性が低下した時のみに一時的に活性化されることが、細胞生存にとって極めて重要であると考えられました。
今回の研究を通じて、Nrf1が小胞体で糖タンパク質として合成され、常に分解を受けながら、必要な時だけDDI2による切断とNGLY1によるアミノ酸編集という二段階の厳密な活性化機構を経て核で働くという、極めて精緻な制御を受けることの必要性が明らかとなりました。
<参考図>

<用語解説>
- (注1)プロテアソーム:
- 真核生物に存在する分子量250万、66個のサブユニットからなる巨大タンパク質分解装置です。ATPを利用してユビキチン化されたタンパク質を分解します。東京都医学総合研究所の故・田中啓二元理事長とハーバード大の故・アルフレッド・ゴールドバーグ博士によって発見されました。
- (注2)Nrf1:
- 小胞体膜に局在する膜貫通型の糖タンパク質。プロテアソームの活性が低下すると、NGLY1により糖鎖が除去され、さらにDDI2にN末端が切断されることで活性化します。活性化されたNrf1は核へ移行し、プロテアソームの合成を誘導する転写因子として働きます。
- (注3)NGLY1によるアミノ酸配列の変換(配列編集):
- 糖鎖修飾はアスパラギンに付加されるN型糖鎖と、セリン・スレオニンに付加されるO型糖鎖があります。N型糖鎖を外す酵素がNGLY1です。NGLY1はアスパラギン残基からN型糖鎖を除去すると同時に、脱アミド反応によってその残基をアスパラギン酸へと変換します。
- (注4)小胞体:
- 細胞膜タンパク質や分泌タンパク質がリボソームで合成されると同時に取り込まれ、ゴルジ体などの分泌経路へ輸送する網状の細胞小器官です。小胞体では糖鎖修飾が行われ、タンパク質が正しく折りたたまれているかをチェックする品質管理機構が働いています。異常タンパク質は小胞体から細胞質へ戻され、プロテアソームによって分解されます。Nrf1は常に異常タンパク質として認識され、恒常的に分解を受けていると考えられています。
- (注5)HCFC1とOGT:
- HCFC1(Host Cell Factor C1)は250 kDaの大きな核内タンパク質で、多くの転写因子と結合することが知られています。OGT(O-GlcNAc 転移酵素)は細胞質や核に存在し、多くのタンパク質のセリンやスレオニンにGlcNAc(O-GlcNAc)を付加する酵素です。HCFC1と結合するとHCFC1の多数の部位にO-GlcNAcを付加するとともに特定部位を切断し、HCFC1の構造を変化させて活性化するとされています。
<本研究の主な助成事業>
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED)「プロテオスタシスの理解と革新的医療の創出」研究開発領域(JP22/23gm14100003h0003/4, JP24gm6410012)、科学研究費補助金(JP22H02305;JP22H00419)、JST-CREST(JPMJCR16H3)などの支援を受けて行われました。
