2026年1月10日
体内時計プロジェクトの乙部優太研究員、吉種光プロジェクトリーダーらの研究グループは「全身32臓器を網羅した「マウス体内時計プロテオーム地図」を作成~次世代質量分析装置 Orbitrap Astral で約1万9千タンパク質の時間変動を一挙解析〜」についてMolecular Cell に発表しました。
全身32臓器を網羅した「マウス体内時計プロテオーム地図」を作成
〜次世代質量分析装置 Orbitrap Astral で約1万9千タンパク質の時間変動を一挙解析〜
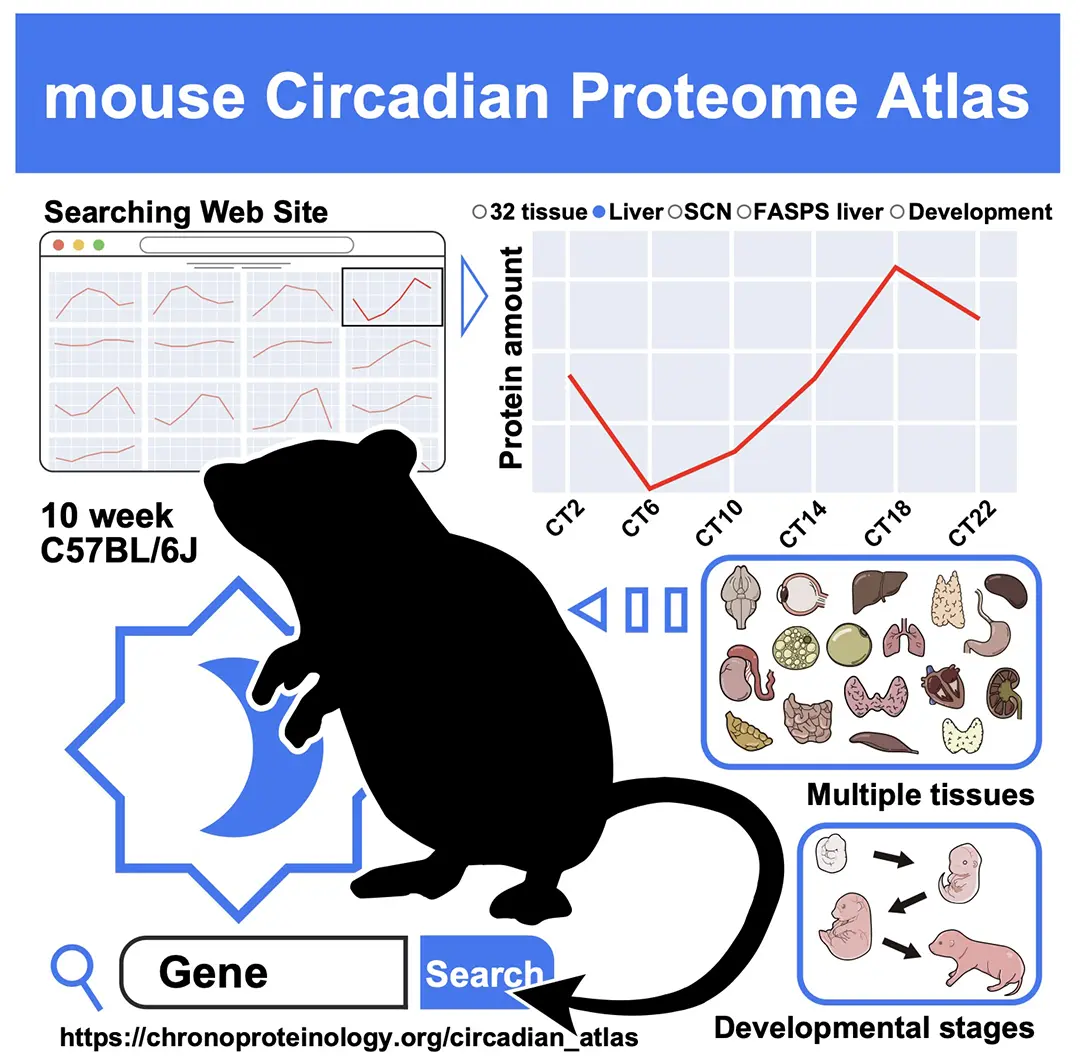
体内時計プロジェクトの乙部優太研究員、吉種 光プロジェクトリーダー(東京大学大学院理学系研究科 准教授兼任)らの研究グループは、次世代質量分析装置 Orbitrap Astral を用いて、マウス全身から 32 の臓器または脳領域におけるタンパク質量やリン酸化状態の 24 時間変動を高精度に解析し、「マウス概日時計プロテオームアトラス(Mouse Circadian Proteome Atlas)」を構築しました。解析の結果、 32 組織・584 サンプルから合計 18,956 種類のタンパク質を同定し、UniProt に登録されているマウス全タンパク質の約 74%をカバーする包括的な“体内時計地図”の作成に成功しました。
本研究のデータは、誰でもインターネット上で閲覧可能なウェブサイト「 Mouse Circadian Proteome Atlas(https://chronoproteinology.org/circadian_atlas )」として公開されており、「いつ(When)、どこで(Where)、どのタンパク質が(Which)」働いているのかを調べるための基盤リソースとして、今後の体内時計研究や創薬研究への広範な活用が期待されます。
)」として公開されており、「いつ(When)、どこで(Where)、どのタンパク質が(Which)」働いているのかを調べるための基盤リソースとして、今後の体内時計研究や創薬研究への広範な活用が期待されます。
この研究成果は 2026年1月10日午前1時(日本時間)に、米国Cell Press社の国際科学誌「Molecular Cell」のオンライン版に掲載されました。
発表論文
- <論文タイトル>
- “Mouse Circadian Proteome Atlas by nzext-generation deep proteome analysis”
(次世代深層プロテオーム解析によるマウス概日時計プロテオームアトラス) - <発表雑誌>
- Molecular Cell
DOI:10.1016/j.molcel.2025.12.020
URL:https://doi.org/10.1016/j.molcel.2025.12.020
研究の背景
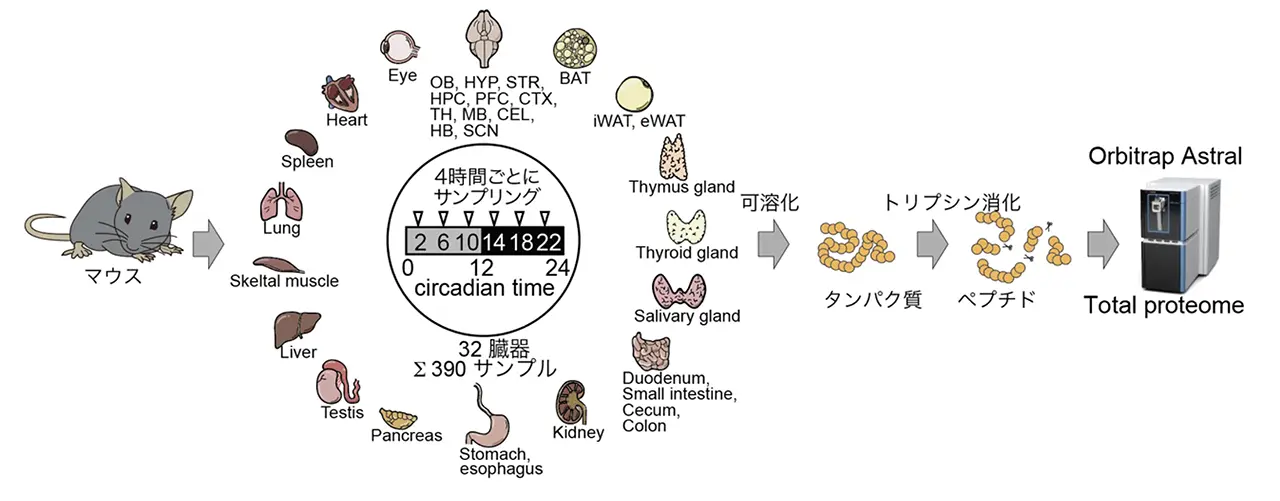
当研究所 体内時計プロジェクトの乙部優太研究員と、吉種光プロジェクトリーダー(東京大学大学院理学系研究科 生物科学専攻 准教授兼任)らの研究グループは、一定の暗条件下(constant dark)で飼育したマウスから、1 日の中で 4 時間ごと 6 時点で全身 32 臓器(脳 10 領域+SCN、脂肪組織、肝臓、心臓、肺、骨格筋、消化管など)を採取し、合計 390 サンプルの全細胞プロテオーム解析を行いました。さらに、発生段階の頭部・体幹部・胎盤サンプルなどを追加し、総計 584 サンプルを Orbitrap Astral で解析しました。
その結果、18,956 種類のタンパク質を同定し、UniProt に登録されたマウス全タンパク質の 73.8%をカバーする高深度のアトラスを構築しました。全身の多様な組織から得られたデータを統合することで、どの組織にどのタンパク質が多く存在するのか、どの時刻にピークをとるのかといった空間的・時間的プロファイルを比較できるようになりました。例えば、代表的な時計転写因子 NR1D1(REV-ERBα)については、多くの組織で夜行性動物であるマウスの休息期に合わせてピークをとること、一方で脳と末梢組織では振幅が異なることなどが明らかになりました。
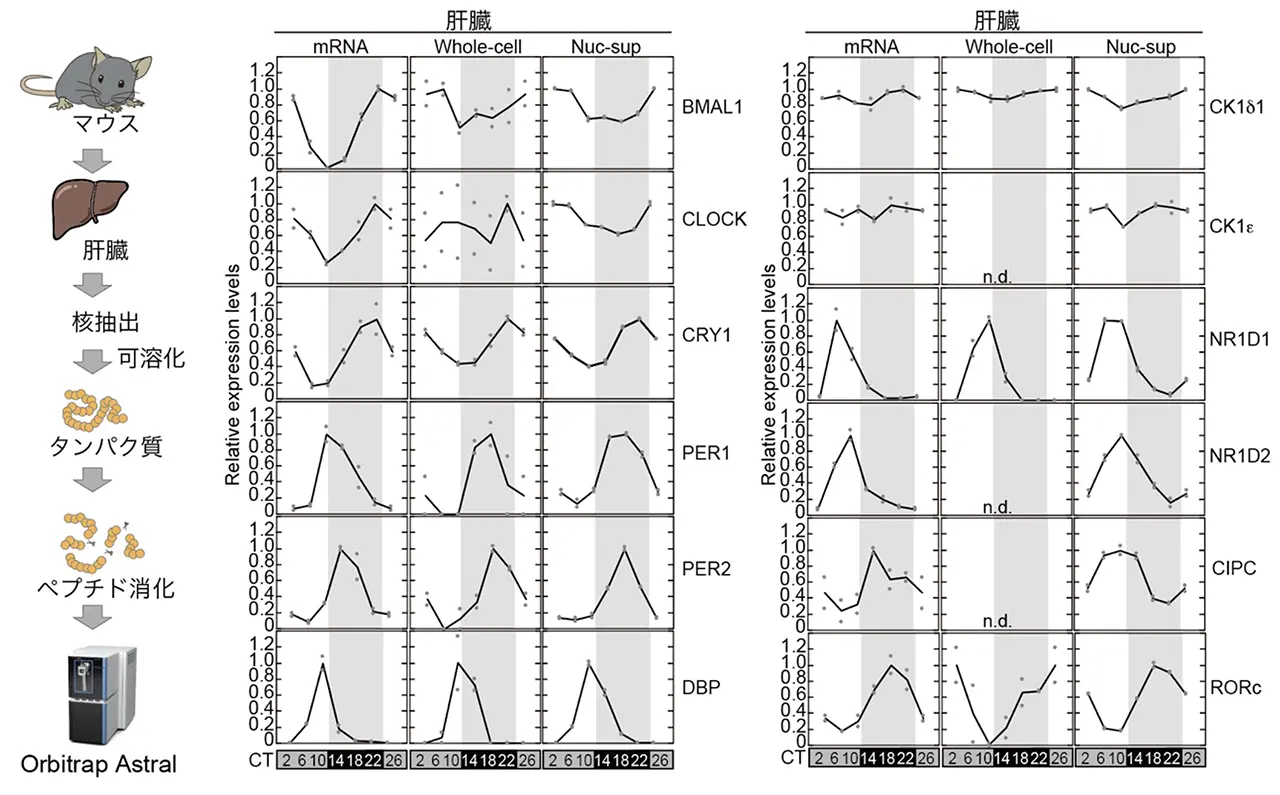
次に、概日時計出力の代表的な臓器である肝臓について、mRNA、全細胞プロテオーム、核画分プロテオーム、リン酸化プロテオームを統合的に解析しました。既報の RNA-seqデータと比較すると、リズム性を示す mRNA の約 2 割程度しかタンパク質レベルではリズム性を示さないことが分かり、mRNA 情報だけでは臓器機能の日内変動を十分に説明できないことが示されました。また、細胞全体で見ると一日を通してその発現量が変化しないタンパク質の中には、核内では顕著な概日リズムを示すタンパク質を多数同定しました。つまり、タンパク質の「量」ではなく「場所」が時刻依存的に制御されているのです。さらに、リン酸化ペプチドの濃縮と Orbitrap Astral による解析により、肝臓全体で 26,725種類、肝臓核画分で 73,444 種類のリン酸化ペプチドを同定し、そのうち約 1〜2 割が 24 時間リズムを示すことを見出しました。多くのリン酸化部位はタンパク質量とは独立したリズムを示しており、キナーゼやホスファターゼの時刻依存的な活性制御が、肝臓機能の概日リズムに大きく貢献していることが示されました。
次世代質量分析装置「Orbitrap Astral」の一つの特徴はその高い感度です。そのため、これまでにはプロテオーム解析の実施が難しかった、とても小さな脳領域をも研究対象とすることができます。本研究では約 2 万の神経核からなる中枢時計 SCN を用いて、プロテオームおよびリン酸化プロテオーム解析を行いました。その結果、小さな脳領域からでも約 1.2万のタンパク質の発現プロファイルを記述することに成功するとともに、多くのリン酸化ペプチドが主観的朝(CT0–3)にピークを持つことが分かりました。Rho GTPase シグナルや細胞突起の構造制御、シナプス小胞輸送など、神経活動の制御に関わる経路がこの時間帯に活性化されていることが示唆されました。
時計遺伝子に多型が見られる家系の中には、睡眠障害との関連が指摘されている家系も報告されています。例えば、PER2 タンパク質の 662 番目の Ser が Gly になる多型を持つ人は、概日リズムの周期が短くなるために、極端な早寝早起きとなり社会生活を送ることが困難になります。このヒトの家族性進行性睡眠相症候群( FASP)の原因変異であるhPER2-S662G を導入した BAC トランスジェニックマウスは、約 22 時間の短い概日周期と約 4 時間の睡眠相前進を示します。本研究では、この hPER2-S662G マウスと対照マウスの肝臓(全細胞および核画分)から 24 時間にわたり試料を採取し、同様のプロテオーム解析を行いました。その結果、PER1 をはじめとする複数の時計タンパク質のピーク時刻が、対照群と比べて平均約 3 時間早まっていることが分かり、行動リズムの前進と一致した分子レベルでの“時計の進み”が示されました。さらに、CAMK2A など多数のタンパク質の発現量や核内局在が変化していること、リン酸化プロテオーム解析からは、PER1-S704や PER2-S971 といった時計タンパク質を含む多くのリン酸化部位のリン酸化レベルが大きく増減していることが明らかになりました。これらの結果から、単一アミノ酸変異による体内時計のずれが、全身のタンパク質量とリン酸化状態に及ぶ広範な変化を引き起こすことが示され、概日リズムの乱れが将来的に代謝疾患や精神疾患などにつながるメカニズム解明の足がかりになると期待されます。
社会的意義・今後の展望
概日時計のリズムは、睡眠・覚醒リズムだけでなく、血圧、血糖、ホルモン分泌、免疫応答など、多くの生理機能の時刻変動と密接に関わっており、その乱れは生活習慣病やがん、うつ病など多彩な疾患リスクの上昇と関連することが報告されています。本研究で構築した「マウス概日時計プロテオームアトラス」は、全身 32 臓器における約 1 万 9 千タンパク質の量・局在・リン酸化状態の時刻変化を網羅的に記述した、世界的にも類例のないリソースです。ウェブブラウザ上で任意のタンパク質名を入力するだけで、自分が知りたいタンパク質がどの臓器で、どの時刻に、どの程度発現しているかを誰でも一目で確認できます。
概日リズムの理解に立脚した医学応用としてクロノセラピー(時間治療)があります。多くの治療薬は細胞内の特定タンパク質を標的としており、例えば標的タンパク質の量や活性に時刻依存性がある場合には、その治療薬においても時刻に応じた効果が期待できます。また、治療薬の標的外タンパク質への作用によって副作用が生じることがありますが標的外タンパク質の量や活性に時刻依存性がある場合には、投薬時刻を工夫することによって副作用を小さくすることができます。このように治療薬自体の改良ではなく、投薬時刻の工夫によって治療効果を最大化する戦略をクロノセラピーと呼び、近年注目を集めています。では実際に、”どの”治療薬を”いつ”投与するのが効果的なのでしょうか。これまではデータベースが充実している RNA リズムを基に治療薬の種類や投薬時刻が考えられてきました。しかし、本研究からも RNA リズムとタンパク質リズムは大きく異なっていることがわかりました。本研究で構築した「マウス概日時計プロテオームアトラス」はクロノセラピーへの応用に向けて極めて有用であると期待できます。
研究助成
本研究は、科学研究費助成事業(科研費)「学術変革領域研究(A)時間タンパク質学」(24H02299、24H02302、24H02306)、「国際共同研究加速基金(国際共同研究強化)」(22K21351)、および日本医療研究開発機構(AMED)(JP256f0137008、JP22gm6410030)の支援を受けて実施されました。
<参考図>
<用語解説>
- プロテオーム解析:
- 細胞や組織に含まれるタンパク質を網羅的に同定・定量する解析手法。質量分析計を用いてタンパク質を断片化したペプチドの質量を測定し、その組み合わせから元のタンパク質種と量を推定する。
- 質量分析計 Orbitrap Astral:
- イオン化されたペプチドの質量を高精度に測定する装置。Orbitrapと呼ばれる高分解能の質量分析部と、Astralと呼ばれる高速検出部を組み合わせることで、1サンプルあたり短時間で非常に多くのタンパク質を高感度に測定できる。
- リン酸化修飾:
- タンパク質の特定のアミノ酸にリン酸基が共有結合する翻訳後修飾の一種。タンパク質の立体構造や相互作用、酵素活性などを変化させ、シグナル伝達や代謝、細胞周期など多くの生命現象を制御する。
