HOME > 広報活動 > 刊行物 > Jan 2019 No.032

Jan. 2019 No.032
特集
Topics
開催報告
編集後記
Topics
不良ミトコンドリアを分解する新しい仕組みを解明
「Elife」にユビキチンプロジェクトの山野晃史主席研究員らの研究成果が発表されました。
ユビキチンプロジェクト 主席研究員山野 晃史
人の体を構成している細胞は37兆個もあると推定されています。また、生命の基本単位である細胞の中は、複雑な膜系構造体が発達しており、多様な生命活動を維持する基盤となっています。細胞内の膜系構造体の一つであるミトコンドリアは、生命活動に必要不可欠なエネルギーを合成する工場です。しかし、ミトコンドリアはエネルギー合成の代償として、時として不良(細胞にとって害となる)になってしまいます。 通常、不良となったミトコンドリアはオートファジーに代表される浄化作用によって、選択的に分解・除去されますが、その選択的分解システムが何らかの原因でうまく働かなくなると、パーキンソン病などの神経変性疾患を発症すると考えられています。
私が所属するユビキチンプロジェクトでは遺伝性パーキンソン病の遺伝子に注目して研究を行ない、「不良ミトコンドリアを適切に分解することでパーキンソン病の発症を抑えていること」を明らかにしてきました。しかし、ダイナミックな膜動態を伴う不良ミトコンドリアの分解機構は複雑で、多くの謎が残されていました。
そこで、私はミトコンドリア膜上に存在するGTPase※の調節因子に着目して研究を行ない、その標的であるGTPaseが適切に調節・制御されないと不良ミトコンドリアの分解が破綻することを見出しました。さらに、通常はエンドサイトーシスに関わる一連のタンパク質が不良ミトコンドリアの分解に関与することを見出しました。エンドサイトーシスは細胞外の物質を細胞内へと取り込むシステムで、その多くはリソソームと呼ばれる分解を担う膜構造体へと運ばれます。一方、細胞内の不良ミトコンドリアも、リソソームへと運ばれ、同様に分解を受けます。
本研究で、不良となったミトコンドリアをリソソームへと運び、効率的に分解するためにはオートファジーのみならず、エンドサイトーシスのシステムが必要であることが判明し、それに関わる複 数のタンパク質が 明らかとなりました。不良ミトコンドリアの分解は、人の健康を考える上でも重要で、高齢化社会をむかえる我が国にとっても、その根本的メカニズムの解明が強く求められています。本研究で得られた知見をもとに、不良ミトコンドリア分解の破綻がパーキンソン病などの神経変性疾患を引き起こすか、さらなる研究の展開へと繋げていきたいと考えています。
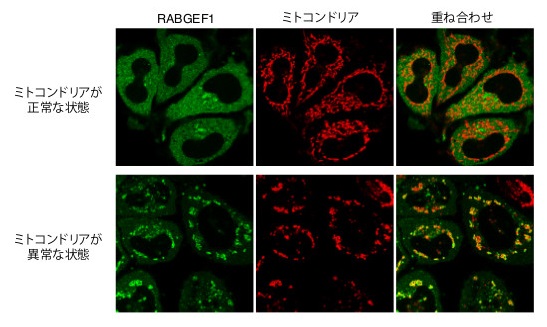
図:ミトコンドリア(赤色)が正常な場合、エンドサイトーシスの上流で機能するRABGEF1(緑色)は細胞全体に存在していますが、ミトコンドリアが異常な状態(不良ミトコンドリア)になると、RABGEF1は不良ミトコンドリアへと局在します。
用語説明
- ※ GTPase:
- グアノシン三リン酸と結合し、加水分解する酵素の総称です。細胞内の膜動態や細胞骨格の調節に機能するものなど、多数存在します。グアノシン三リン酸と結合する状態と加水分解後の状態の違いを利用して分子スイッチとして働くことが知られています。
参考文献
Endosomal Rab cycles regulate Parkin-mediated mitophagy.
Yamano K, Wang C, Sarraf SA, Münch C, Kikuchi R, Noda NN, Hizukuri Y, Kanemaki MT, Harper W, Tanaka K, Matsuda N, Youle RJ.
Elife. 7. pii: e31326.
doi: 10.7554/eLife.31326.

山野 晃史 主席研究員
生体分子先端研究分野
ユビキチンプロジェクト
「2018年度日本生化学会奨励賞」を受賞
新年の目標
ミトコンドリアという細胞のエネルギー生産に必要なオルガネラを如何に健康な状態で維持するか。細胞は様々な手段で、その恒常性を維持しています。本年も、人類がまだ理解していないそのメカニズムを引き続き探求し、個性的で発展性のある基礎研究の遂行に邁進したい。さらにユビキチン、オートファジー、ミトコンドリアをキーワードとする研究を若手研究者から盛り上げていけるような活動にも積極的に参加したい。

