2025年1月17日
細胞膜研究グループの小倉潔研究員、笠原浩二主席研究員らは、「腫瘍増殖抑制剤の新規分子標的としてのHGS及び新規腫瘍増殖抑制剤としてのHGS構成オリゴペプチドOP12-462の発見」について International Journal of Molecular Sciences に発表しました。
腫瘍増殖抑制剤の新規分子標的としてのHGS
及び新規腫瘍増殖抑制剤としてのHGS構成オリゴペプチドOP12-462の発見
論文情報
- <論文タイトル>
- “HGS Promotes Tumor Growth, Whereas the Coiled-Coil Domain and Its Oligopeptide of HGS Suppress It”
- <著 者>
- 小倉潔、川島育夫、笠原浩二
- <発表雑誌>
- International Journal of Molecular Sciences2025 26(2)772
DOI:https://doi.org/10.3390/ijms26020772
研究背景
細胞が癌化すると糖脂質の糖鎖構造が変化することはよく知られ、実際に糖脂質糖鎖の多くが腫瘍マーカーとして診断に利用されている。同時に糖脂質糖鎖の変化が、癌化とどのように関わっているかについての研究も進められている。また、正常形態形成及び正常機能における糖脂質の重要性についての研究も進んでいる。オリゴデンドロサイトは、神経軸索を覆うミエリンを形成する特殊な形態と絶縁体としての役割を担っているが、ガラクトシルセラミドとその硫酸化誘導体スルファチドはオリゴデンドロサイトの分子マーカーであり、小脳の湿重量の3割を占めるほどミエリンに大量に発現している。これらの糖脂質はオリゴデンドロサイトの特殊形態と軸索の絶縁機能に必須であることが判明している。
我々は以前、ガラクトシルセラミド発現に注目し、抗ガラクトシルセラミド抗体を用いた動物細胞発現クローニング法を用いてガラクトシルセラミド発現に関与するガラクトシルセラミド発現因子-1のcDNAを単離した。この蛋白質はHepatocyte-growth-factor–regulated tyrosine kinase substrate (HGS)のホモログであり、種々の培養細胞にガラクトシルセラミド発現と形態変化を誘導した。HGS はユビキチン化蛋白質をエンドソーム内小胞に輸送・隔離する機能を担っている。
研究概要
培養細胞におけるHGS高発現は、がん細胞において特徴的なTGF-β-SMAD及びWnt-β-catenin情報伝達を活性化し、がん細胞において特徴的な足場非依存的増殖能を亢進した。その結果、正常細胞はがん化し、がん細胞は悪性化し、腫瘍増殖能が亢進した。一方、HGSのドミナントネガティブ効果を有するHGSのコイルド-コイル領域蛋白質やその構成オリゴペプチドOP12-462は、TGF-β-SMAD及びWnt-β-catenin情報伝達を抑制し、足場依存的増殖能には影響を与えず、足場非依存的増殖能のみを阻害し、腫瘍増殖能を抑制した。
本研究では、がん細胞の腫瘍増殖における足場非依存的増殖能に対するHGSの亢進作用及びHGSのコイルド-コイル領域蛋白質並びにその構成オリゴペプチドOP12-462による抑制作用について解明し、HGSががん細胞増殖のみを阻害する腫瘍増殖抑制剤の新規標的分子となる可能を示唆した。
今後の展開
HGSのコイルド-コイル領域蛋白質及びその構成オリゴペプチドOP12-462は、HGSの機能阻害薬として、正常細胞に対してダメージを与えることなく、腫瘍細胞の増殖だけを抑制できる新規腫瘍増殖抑制剤のシード化合物としての研究が期待される。また、HGS自体は腫瘍増殖抑制剤の新規標的蛋白としての研究展開が期待される。特にHGSの発現抑制剤及び特異的代謝分解剤は、正常細胞増殖に影響を与えず、腫瘍細胞の増殖だけを抑制できる新規腫瘍増殖抑制剤として開発が期待される。さらに、これらはがん疾患に限らず、TGF-β-SMAD及びWnt-β-catenin情報伝達の亢進により増悪化する疾患に対しても治療薬としての展開が期待される。
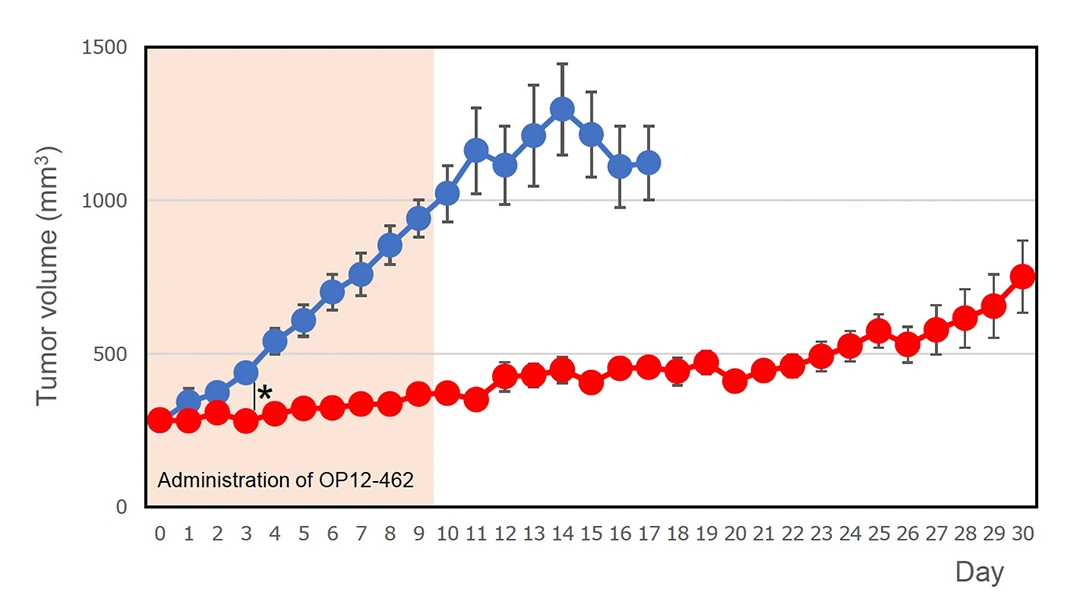
COLO205細胞をヌードマウス(n = 5)の側腹部に皮下接種した。腫瘍容積が250 mm3を超えた日を0日目とした。オリゴペプチドOP12-462(50 mg/kg体重)を0.2 mL PBS溶液として1日1回、0日目から9日目までの10日間尾静脈に投与した。3日目以降、OP12-462群と溶媒群の腫瘍容積の差は統計的に有意であった。
vehicle, (●); OP12-462 (●).アスタリスクは統計的有意性を示す。
