2025年7月26日
視覚病態プロジェクトの原田高幸 プロジェクトリーダーらは「視神経の再生に新たな可能性 ~DOCK3とHAUS7の連携が軸索再生を促進~」についてScience Advances に発表しました。
視神経の再生に新たな可能性 ~DOCK3とHAUS7の連携が軸索再生を促進~
当研究所 視覚病態プロジェクトの原田 高幸 プロジェクトリーダー、行方 和彦 研究員、篠崎 陽一 研究員らは、東北大学大学院医学系研究科・眼科学教室の清田 直樹 医師(元・東京都医学総合研究所 協力研究員)、中澤 徹 教授らと共同で、「HAUS7(ハウスセブン)」が視神経再生を促進する分子であることを発見し、その機能メカニズムを解明しました。本研究成果は、緑内障や視神経外傷といった視神経疾患に対する新たな治療法の開発につながる可能性を示すものであり、再生医療や神経修復研究の分野において重要な一歩となることが期待されます。
この成果は、米国科学振興協会(AAAS)が発行するオープンアクセス学術誌「Science Advances」のオンライン版において、米国東部時間 2025年7月25日 付けで先行公開されました。
論文情報
- <論文タイトル>
- “Role of HAUS7 as a DOCK3 binding partner in facilitating axon regeneration”
(HAUS7はDOCK3の結合パートナーであり視神経再生を促進する) - <発表雑誌>
- Science Advances
DOI:10.1126/sciadv.adq7105
研究の背景
私たちの視覚は、目から脳へと情報を伝える「視神経」によって成り立っています。しかし、緑内障などの病気や外傷によって視神経が損傷すると、視機能が大きく低下し、場合によっては失明に至ることもあります。現代の医療においては、こうした損傷を受けた視神経の回復は極めて困難であり、その主な要因として、視神経の再生を促す仕組みが十分に解明されていないことが挙げられます。
このような背景のもと、視覚病態プロジェクトでは、長年にわたる研究の成果として、「HAUS7」という遺伝子が視神経再生に重要な役割を担っていることを発見しました。研究チームは、モデル動物を用いた実験により、そのメカニズムを明らかにすることに成功しました。
本成果は、視神経の再生を分子レベルで制御するための新たな手がかりを提供するものであり、緑内障や視神経損傷といった難治性疾患の克服に向けた治療法の開発につながることが期待されます。
研究の概要
研究グループは、神経の保護および再生に関わる新たな分子機構を発見しました。神経栄養因子であるBDNF(脳由来神経栄養因子)のシグナル伝達によって活性化されるタンパク質DOCK3が、視神経の再生において重要な役割を果たすことに関して、これまでに多くの報告を行ってきました。
本研究では、DOCK3と結合する新たな分子を探索した結果、HAUS7(HAUS augmin like complex subunit 7)というタンパク質を新たに同定しました。HAUS7は、微小管の分岐形成に関与するオーグミン(Augmin)複合体の構成因子の一つであり、これまで主に細胞分裂の場面で注目されてきた分子です。
研究グループの実験により、HAUS7はDOCK3と結合して神経細胞の軸索[注1]内を移動し、軸索の伸長に必要な微小管の分岐を促進することで視神経の再生を誘導することが明らかとなりました。
視神経は、網膜の神経節細胞から脳へと視覚情報を伝達する重要な経路ですが、一度損傷を受けると再生が困難で、視機能の回復が難しいとされています。これまでに研究グループは、BDNF/TrkB経路によって活性化されるDOCK3が、網膜神経節細胞や視神経の保護・再生に不可欠であることを報告してきました。
そこで本研究では、DOCK3と連携して働く未解明の分子を明らかにすることを目的とし、酵母ツーハイブリッド法[注2]を用いてDOCK3と相互作用するタンパク質を網羅的に探索しました。
その結果、微小管の形成と分岐に関与するHAUS7を、DOCK3の新たな結合因子として同定しました。HAUS7はHAUS1~8で構成されるオーグミン複合体の一員であり、オーグミン複合体は微小管の分岐構造を形成する働きを持つことが知られています。
次に、研究グループはHAUS7が軸索の伸長を制御するメカニズムについて調べました。培養した神経細胞を用いた実験の結果、DOCK3がHAUS7を細胞体から軸索の先端にある成長円錐[注3]まで運ぶ役割を果たしていることが明らかになりました。DOCK3の発現をshRNA[注4]を使って抑制すると、HAUS7の成長円錐への輸送が減少し、その結果、軸索の伸長も抑えられました。
具体的には、赤色蛍光タンパク質が付いたHAUS7(Haus7-DsRed)と、緑色蛍光タンパク質が付いたDOCK3に対するshRNA(shDock3-ZsGreen)を神経細胞に導入したところ、緑色に染まったDOCK3が抑制された細胞では、HAUS7の赤いシグナルが細胞体にとどまり、軸索には移動しませんでした(図1a)。一方、DOCK3を抑制しない対照の細胞では、HAUS7の赤いシグナルが軸索の先端まで伸びていました。
さらに、DOCK3の発現を抑えた神経細胞では、成長円錐におけるHAUS7のシグナルが大幅に減少することも確認されました(図1b)。これらの結果から、HAUS7はDOCK3の制御によって神経軸索内を移動し、成長円錐に到達して軸索伸長に寄与していることが示されました。
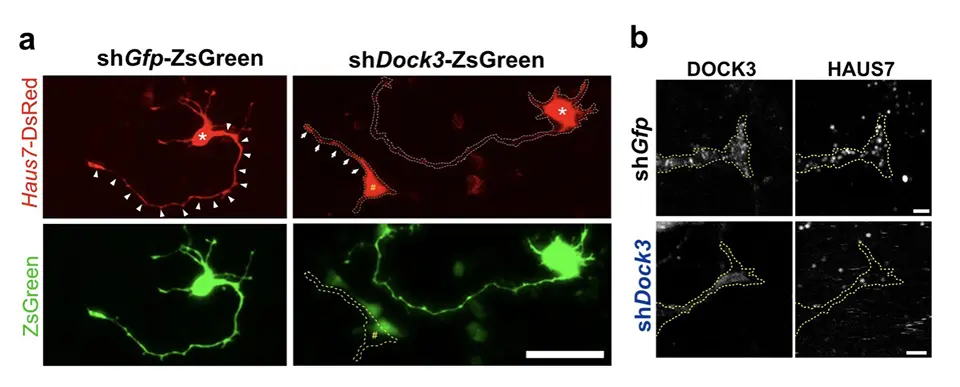
DOCK3をshDock3-ZsGreenでノックダウンすると(下段右、緑色)、DsRedで標識したHAUS7(上段右、赤色)が細胞体(*)に留まり、軸索の先端へ移動しない。対照群(shGfp-ZsGreen、DOCK3はノックダウンされない)では、赤色のシグナルが軸索先端まで移動している(上段左)。
DOCK3ノックダウンにより、成長円錐内のHAUS7シグナルが顕著に減少する(下段右)。
また、BDNF/TrkBシグナルが、DOCK3とHAUS7の相互作用に関与することを明らかにしました。具体的には、BDNFの刺激によってDOCK3のY562部位がリン酸化され(図2a)、このリン酸化によりHAUS7がDOCK3から解離することが示されました(図2b)。
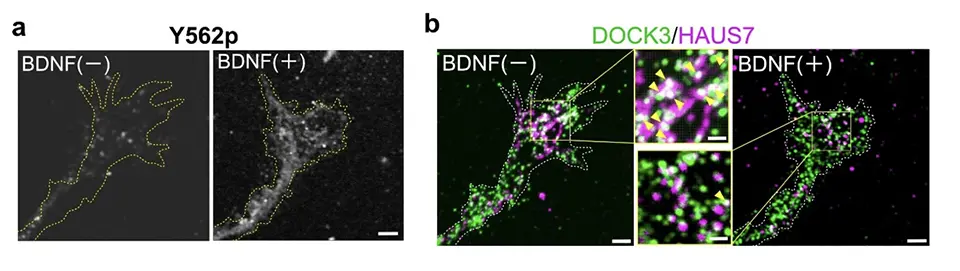
BDNF刺激により、DOCK3のY562部位がリン酸化される様子を、自作したリン酸化特異抗体により細胞内で可視化。BDNF投与後(右)では、成長円錐領域におけるリン酸化DOCK3のシグナルが顕著に増加している。
BDNFはDOCK3とHAUS7の結合を解離させる作用を持つ。BDNF投与前(中央上段)ではDOCK3とHAUS7の複合体(黄色矢頭)が確認されるが、投与後(中央下段)ではそのシグナルが大きく減少しており、両者の結合が阻害されたことを示している。
HAUS7の生体内での役割を明らかにするため、研究グループはHAUS7遺伝子を欠損させたマウスを作製し、視神経の構造と再生能力を解析しました。電子顕微鏡を用いて視神経軸索を観察したところ、HAUS7欠損マウスでは、正常マウスと比較して軸索内の微小管の数が著しく減少していることが確認されました(図3a)。これは、HAUS7が微小管の形成や維持に関与している可能性を示しています。
さらに、視神経外傷モデルを作製し、軸索再生を促進する遺伝子治療を実施したところ、HAUS7欠損マウスでは正常マウスに比べて視神経の再生能力が大きく低下していました(図3b)。これらの結果から、HAUS7は視神経軸索内の微小管の安定化を通じて、視神経の再生に不可欠な役割を果たしていることが示されました。
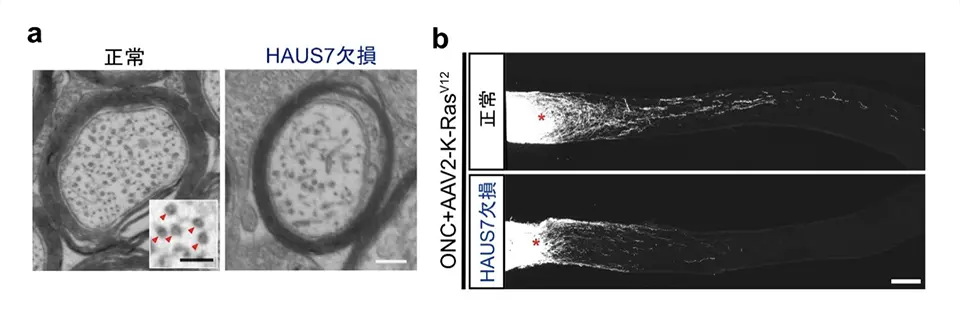
視神経軸索の断面図(電子顕微鏡画像)。HAUS7欠損マウス(右)では、生まれつき正常マウス(左)に比べて、微小管(赤色矢頭)の数が減少していることが確認された。
視神経損傷マウスに対して遺伝子治療を施し視神経再生を誘導した結果、HAUS7欠損マウス(下段)では正常マウス(上段)に比べて、視神経の再生能力が大きく減弱していた。
視神経外傷に加えて、日本における最大の失明原因である緑内障との関連についても検討を行いました。公開データベースを用いた遺伝子発現解析の結果、緑内障モデルマウスではHaus7およびDock3遺伝子の発現が低下していることが明らかになりました。一方で、軸索再生を促進する遺伝子治療を受けた視神経損傷モデルマウスの網膜神経節細胞においては、Haus7遺伝子の発現が高いことがわかりました。
以上の研究結果から、DOCK3の結合分子としてHAUS7が軸索再生に不可欠であり、視神経の再生にも重要な役割を果たしていることが明らかとなりました(図4a)。さらに、緑内障モデルにおいてHaus7の発現が低下していることが確認され、HAUS7の機能障害が緑内障における視機能障害の一因である可能性が示唆されました(図4b)。
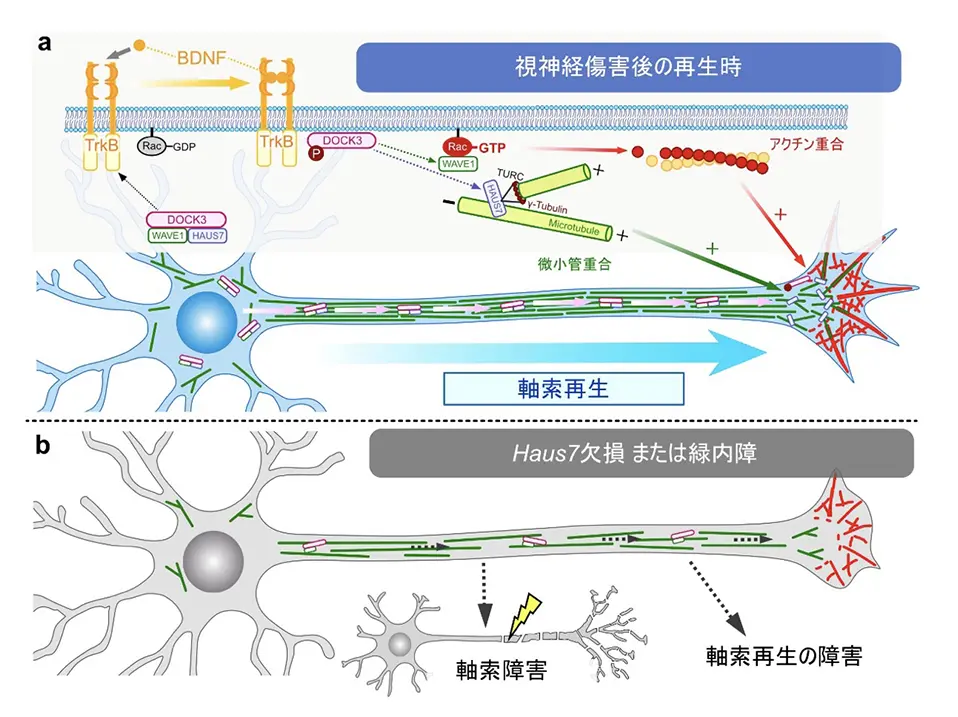
DOCK3と結合するHAUS7は、視神経軸索内を移動し、微小管の分岐を促進することで軸索再生を誘導し、視神経の再生に不可欠である。
緑内障モデルマウスでは Haus7 の発現が低下しており、HAUS7の機能障害が視神経障害・視機能障害の一因である可能性が示された。
今後の展望
緑内障に対しては現在、主に眼圧を下げる治療法が中心であり、視神経の損傷からの回復は困難とされてきました。しかし、本研究で明らかとなったHAUS7およびAugminファミリー分子の軸索再生における重要な役割は、新たな治療戦略の可能性を示しています。今後はHAUS7の機能や作用機序をさらに詳細に解明し、緑内障や視神経外傷に対する効果的な視機能回復法の開発に向けた研究を進めていく予定です。これにより、失明予防や視力回復を目指す革新的な治療法の創出が期待されます。
本研究の主な助成事業
本研究は、日本学術振興会(JSPS)科学研究費補助金(挑戦的萌芽研究・基盤研究)、公益財団法人 武田科学振興財団、三菱財団などの助成を受けて実施されました。
用語説明
- [1]軸索
- 軸索は脳などの神経組織に存在する神経細胞(ニューロン)の一部分で、情報を他の細胞へ伝達するための「ケーブル」の役割を果たします。細胞体から伸びる細長い突起であり、電気信号を他の神経細胞とのシナプスまで伝える役割を持っています。
- [2]酵母ツーハイブリッド法
- 酵母ツーハイブリッド法(Yeast Two-Hybrid System)は、2つのタンパク質間の相互作用を検出するための実験手法です。この方法は、未知の相互作用パートナーを探索したり、既知のタンパク質間相互作用を確認するために広く利用されています。酵母を用いることで、細胞内でのタンパク質結合を効率的に解析できます。
- [3]成長円錐
- 成長円錐は、神経細胞が発達・再生する際に軸索や樹状突起の先端に形成される特殊な構造で、進むべき方向を制御する「先導役」を担います。動的に形を変えながら外部のシグナルを感知し、軸索や樹状突起を適切な方向へ伸ばす働きを持っています。
- [4]shRNAによるノックダウン
- shRNA(短鎖ヘアピンRNA)は、特定の遺伝子の発現を抑制する技術で、RNA干渉の仕組みを利用しています。shRNAはヘアピン状の二次構造を持つ人工的なRNAで、細胞内で標的遺伝子のmRNAに結合し、その分解を促進することで遺伝子の発現を低下(ノックダウン)させます。
