2025年4月23日
カルパイングループの久恒智博主席研究員、小野弥子プロジェクトリーダー(当時)らは「肢帯性筋ジストロフィーR1責任遺伝子産物カルパイン3のプロテアーゼ活性の役割を解明」についてJournal of Biological Chemistry に発表しました。
肢帯性筋ジストロフィーR1責任遺伝子産物カルパイン3のプロテアーゼ活性の役割を解明
当研究所カルパイングループの久恒智博 主席研究員、小野弥子 プロジェクトリーダー(当時)らは、肢帯性筋ジストロフィーR1 (LGMDR1)の責任遺伝子産物“カルパイン3”の筋細胞における動態の解明とその基質の同定に成功しました。本研究成果は、カルパイン3の欠損により発症するLGMDR1の発症機序の解明に繋がるものと期待されます。
本研究成果は、4月23日付け発行の米国科学雑誌「Journal of Biological Chemistry」のオンライン版に掲載されました。
論文情報
- <論文タイトル>
- “In situ detection of activation of CAPN3, a responsible gene product for LGMDR1, in mouse skeletal myotubes”
- <著者>
- 久恒智博、大内史子、秦勝志、小野弥子
- <発表雑誌>
- Journal of Biological Chemistry
DOI:10.1016/j.jbc.2025.108536
発表のポイント
- ①活性化型カルパイン3を特異的に認識する抗体の作製に成功
- ②マウスの筋細胞におけるカルパイン3の活性化状態を可視化
- ③カルパイン3のプロテアーゼ活性の役割の解明
研究の背景
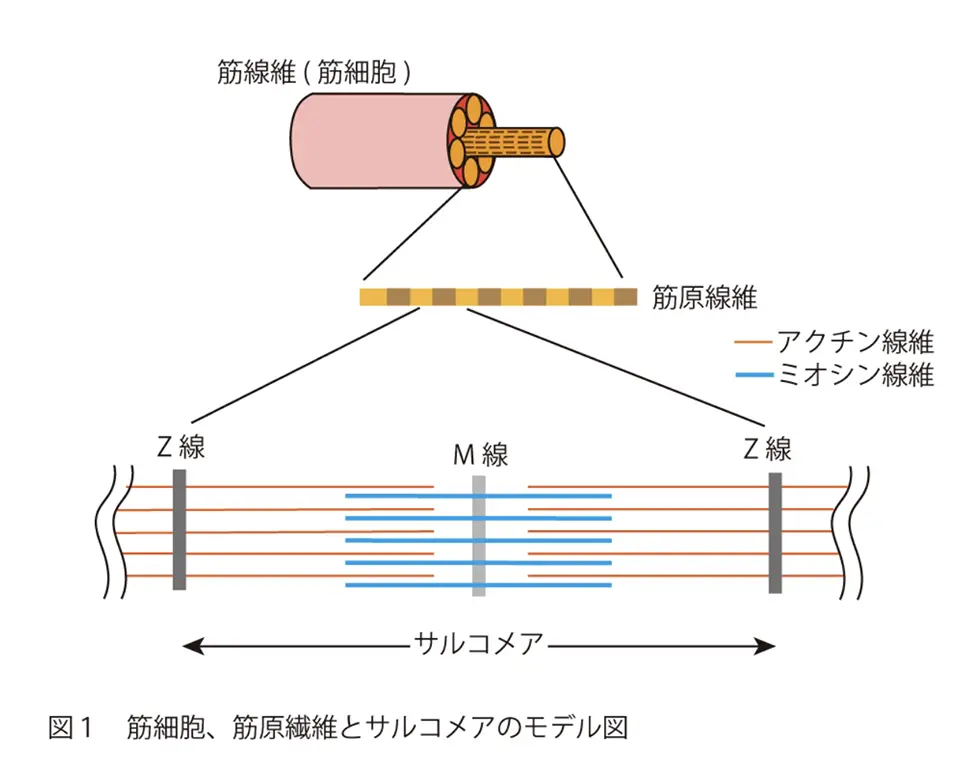
肢帯型筋ジストロフィーR1(LGMDR1)[1]は、四肢の近位筋の筋力低下を特徴とする、10万人に約2人の割合で発症する難病です。患者の多くは思春期以降に発症し、徐々に筋力の低下が進行して、30歳前後に車椅子を必要とすることが知られています。これまでに根治的な治療法は確立されていません。1990年初頭にLGMDR1の責任遺伝子としてカルシウム依存性システインプロテアーゼ[2]の「カルパイン[3]3」が同定された後、LGMDR1の発症機序を明らかにするためにカルパイン3の生化学的な特徴が数多くの研究者により研究されてきました。その結果、カルパイン3が古典型カルパイン[4]と違いプロテアーゼ領域内に挿入配列を有すこと、そのため自己消化による挿入配列の排除が他の基質の分解に必要なこと、筋原線維[5]のサルコメア[6](図1)を構成する構造タンパク質の一つ“タイチン”[7]に相互作用する分子であることなどが明らかにされてきました。しかし、その急速な自己消化特性のために、骨格筋におけるその活性化メカニズムと生理学的機能は未だ完全に明らかになっておらず、特に、カルパイン3が筋細胞内においていつどこで活性化し、何を基質として分解するかは大きな未解決問題となっています。
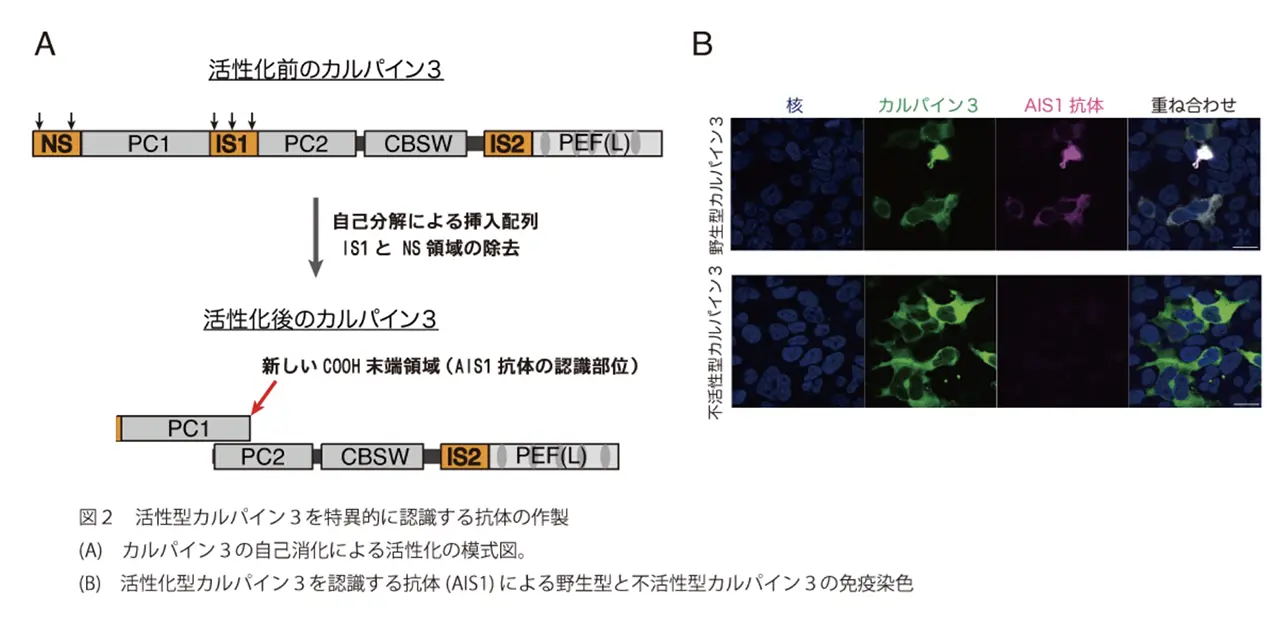
今回研究グループは、活性化する際のカルパイン3の自己消化に着目し、自己消化によって生じるタンパク質断片の末端のみ認識する抗体の作製に挑戦しました。その結果、野生型カルパイン3は認識するが、不活性型カルパイン3を認識しない抗体の作製に初めて成功しAutolytic site within IS1 (AIS1) 抗体と名づけました(図2)。このAIS1抗体により、培養細胞に強制発現させたカルパイン3が強心配糖体[8]のウアバインにより活性化する様子を可視化することが可能になりました。さらにこの活性化の際には、大きな細胞内カルシウム[9]の上昇は起こらず、持続的で僅かなカルシウム上昇のみ起こることもカルシウムイメージング法により明らかにしました。
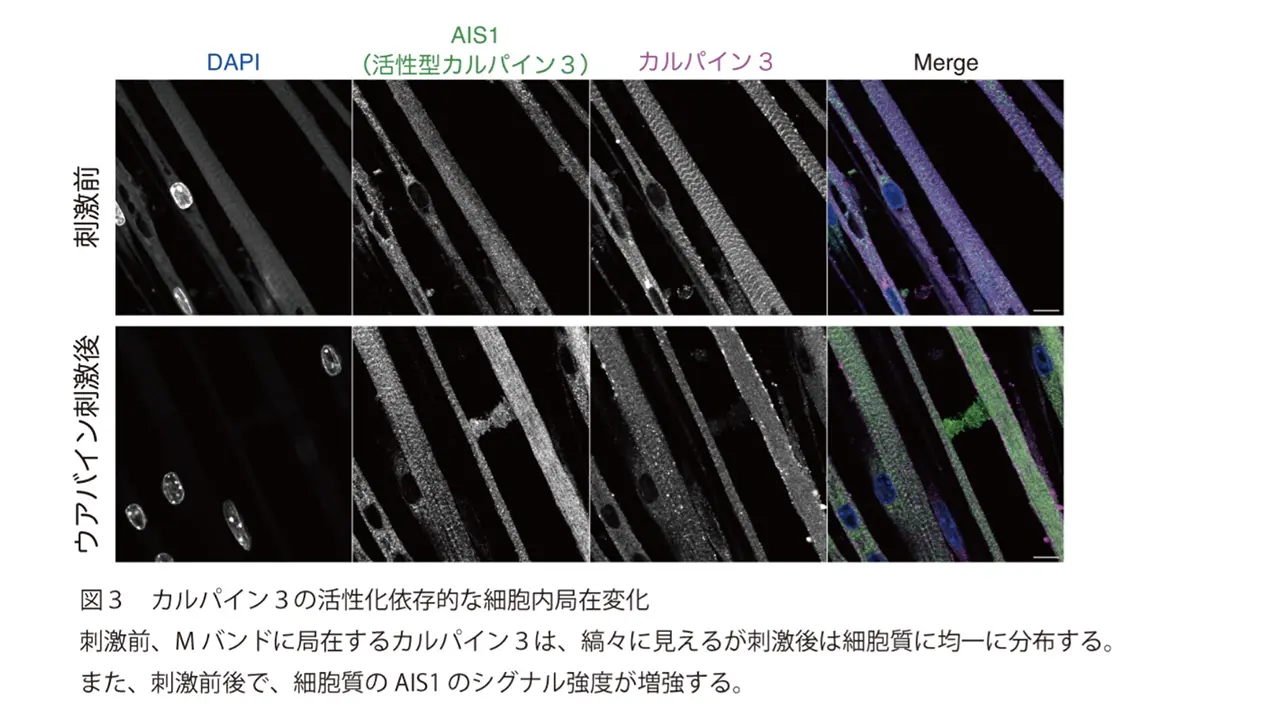
次に研究グループは、初代培養した骨格筋細胞に発現するカルパイン3の細胞内局在について調べました。その結果、静止状態の骨格筋細胞においてカルパイン3がサルコメアのMバンドに主に局在することを明らかにしました。さらにウアバイン刺激により、カルパイン3がMバンドから細胞質へ移行することを明らかにしました(図3)。このカルパイン3の局在変化は、カルパイン3の活性欠損型変異体のノックインマウスから得られた骨格筋細胞ではみられませんでした。このことから、カルパイン3のプロテアーゼ活性は、カルパイン3の細胞内局在変化に必須ということを証明しました。
最後に、活性化してMバンドから細胞質に移行したカルパイン3が何を基質とするのか調べました。その結果、これまでに試験管内でカルパイン3が分解することが報告されていた細胞骨格タンパク質のスペクトリンとタリンの分解がカルパイン3の活性化の時間経過に同調してみられました。その一方、それらの分解はカルパイン3を欠損した筋細胞では起こりませんでした。このことから、スペクトリンとタリンが骨格筋細胞におけるカルパイン3の内在性の基質であることが強く示唆されました。
今後の展望
本研究によって、カルパイン3のプロテアーゼ活性は、骨格筋サルコメアのMバンドから細胞質へのカルパイン3の移動に必要なこと、また細胞骨格タンパク質のスペクトリンやタリンの分解に必要なことを明らかにしました。LGMDR1の患者に見つかるカルパイン3には、プロテアーゼ活性が弱い変異体が報告されており、カルパイン3によるスペクトリンやタリンの分解が起こらないことがLGMDR1発症のメカニズムの一部になっていると考えられます。また今回、ウアバインは細胞内カルシウムを持続的かつ僅かに上昇させることでカルパイン3を活性化させることが明らかとなりました。カルパイン3は筋細胞の収縮時におこる一過性の大きなカルシウム上昇では活性化しないとされています。筋細胞内で持続的かつ僅かにカルシウム上昇させるような生理的条件は何なのか、また僅かなカルシウム上昇でもカルパイン3が活性化するのはどうしてなのか今後明らかにする必要があります。また、ウアバインはカルパイン3を選択的に活性化することのできる薬剤です。この実験系を利用して今後さらにカルパイン3の基質の同定を進めることでLGMDR1の発症機序に新しい知見を与えることが出来、それをベースにしたLGMDR1の治療法の開発に発展することが期待されます。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費基盤研究(C)(研究代表者:久恒智博、Grant Number 22K07014)、科学研究費基盤研究(C)(研究代表者:小野弥子、Grant Number 22K06156)の研究費支援を受けて行われました。
用語解説
- [1]肢帯性筋ジストロフィーR1(LGMDR1)
- 筋力の低下と筋肉の萎縮を特徴とする進行性の筋疾患の一つ。LGMDR1は、主に体幹に近い筋肉(近位筋)に影響がみられ、運動機能障害を起こす。
- [2]カルシウム依存性システインプロテアーゼ
- システイン残基を活性中心にもつタンパク質分解酵素(プロテアーゼ)の一つ。中でも、カルシウム依存性システインプロテアーゼは、カルシウムの結合による構造変化によって活性化し、タンパク質を分解する。
- [3]カルパイン
- 細胞内でカルシウムイオンに依存して活性化してタンパク質を限定的に分解するプロテアーゼの一つ。ヒトにおいては、15種類のカルパインが報告されている。カルパイン活性の不全・異常は、筋疾患、神経機能、糖尿病、皮膚疾患、眼疾患などの発症・悪化と関わりがあると考えられている。
- [4]古典型カルパイン
- カルパイン1と2と同じドメイン構造をもつカルパイン。N末端αヘリックス,プロテアーゼドメイン[PC1およびPC2],CBSW(calpain-type β-sandwich)ドメイン,PEF(penta-EF-hand)ドメインという構造からなる(図2A参照)。
- [5]筋原線維
- 主な構成成分のミオシンフィラメントとアクチンフィラメントが規則正しく並んだ筋細胞内の構造。筋肉組織を構成する基本的な単位であり、ミオシン線維がアクチン線維をたぐり寄せて滑り込ませることで筋収縮が起こる。
- [6]サルコメア
- 筋原線維の最小構成単位。Z線からZ線の間を指す。サルコメアが繰り返し繋がったものが筋原線維。
- [7]タイチン
- サルコメアのZ線からM線にまたがり存在する分子量3,000~3,700 kDaの巨大タンパク質。コネクチンとも呼ばれ、分子内に弾性をもつドメイン構造をもち受動的な伸張に対して張力を生じる。
- [8]強心配糖体
- 心臓の収縮力の増強作用をもつ。ステロイド骨格に糖が結合した構造をもつ化合物。
- [9]細胞内カルシウム
- 細胞外のカルシウム濃度は~1 mMであるのに対し、細胞内のカルシウム濃度は平常時〜100 nMという低濃度に調節されている。細胞が細胞外から様々な刺激を受けた際、細胞内に存在する小胞体からのカルシウム放出と細胞外からのカルシウムの流入により細胞内のカルシウム濃度が上昇することが知られる。