
2019年4月15日
感染制御プロジェクトの山根大典 主席研究員らは「ウイルス感染を抑制する新たな肝細胞の自然免疫シグナルの仕組み」について英国科学雑誌「Nature Microbiology」に発表しました。
ウイルス感染を抑制する新たな肝細胞の自然免疫の仕組みを発見
(公財)東京都医学総合研究所・感染制御プロジェクトの山根大典主席研究員、小原道法特任研究員と米国ノースカロライナ大学・チャペルヒル校のStanley Lemon教授らの研究チームは、ウイルス複製を強力に抑制する肝細胞の自然免疫機構の新たな仕組みを明らかにしました。これまで細胞の持つ抗ウイルス機能は、ウイルス感染に応答して活性化されるとした定説を覆す発見で、抗ウイルス作用に関与する転写因子であるインターフェロン制御因子1(IRF1)* が、基底レベルで抗ウイルスタンパク質の発現維持をすることにより、強力な抗ウイルス作用を発揮することをはじめて明らかにしました。この発見は宿主細胞がウイルス感染を抑制する仕組みに新たな概念を提唱するもので、IRF1の活性化および作用機序を今後詳細に解明することで、新たなウイルス治療法の開発に繋がることが期待されます。
研究成果は、2019年4月15日に英国科学誌「Nature Microbiology」にオンライン掲載されました。
- <論文情報>
- Basal expression of interferon regulatory factor 1 drives intrinsic hepatocyte resistance to multiple RNA viruses
「基底レベルで発現するインターフェロン制御因子1が肝細胞のRNAウイルス感染に対する耐性を制御する」
Daisuke Yamane, Hui Feng, Efraín E. Rivera-Serrano, Sara R. Selitsky, Asuka Hirai-Yuki, Anshuman Das, Kevin L. McKnight, Ichiro Misumi, Lucinda Hensley, William Lovell, Olga González-López, Ryosuke Suzuki, Mami Matsuda, Hiroki Nakanishi, Takayo Ohto-Nakanishi, Takayuki Hishiki, Eliane Wauthier, Tsunekazu Oikawa, Kouichi Morita, Lola M. Reid, Praveen Sethupathy, Michinori Kohara, Jason K. Whitmire, and Stanley M. Lemon - <発表雑誌>
- 英国科学誌「Nature Microbiology」(2019年4月15日オンライン掲載)
https://www.nature.com/articles/s41564-019-0425-6
DOI: 10.1038/s41564-019-0425-6
1. 研究の背景
A型肝炎ウイルスやC型肝炎ウイルス、デングウイルス等の病原体は、肝細胞に感染し増殖することで急性・慢性肝炎を引き起こし、肝機能障害や肝癌を引き起こすことが公衆衛生上重要な問題となっています。肝臓組織を構成する肝実質細胞は本来、ウイルス複製を抑制する自然免疫機構を備えていることは認識されていましたが、ウイルス複製を抑制する詳細な仕組みについては不明でした。
2. 研究の概要
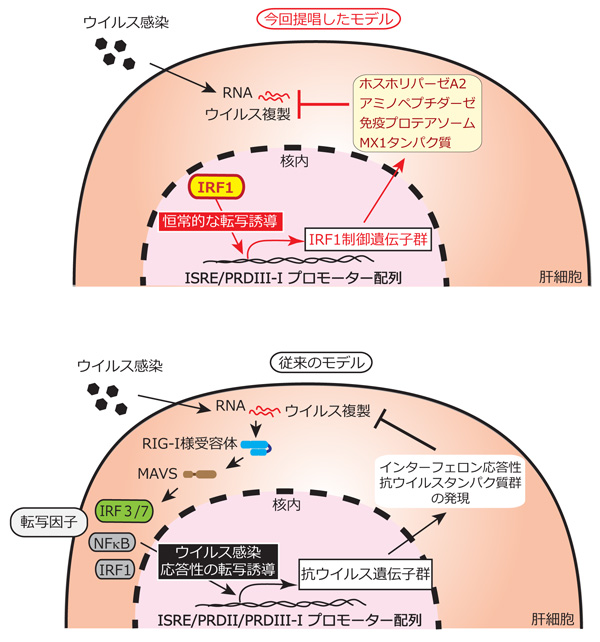
肝細胞においてウイルス複製の抑制に働く宿主因子を明らかにするため、抗ウイルスシグナル経路を構成する一連の遺伝子を各々ノックダウンした不死化肝細胞株(PH5CH8細胞)を樹立し、A型肝炎ウイルスおよびC型肝炎ウイルスの複製量に変化のみられる細胞株を探索しました。これまでの報告では、感染したウイルスRNAをRIG-I様受容体やToll様受容体等のパターン認識受容体が、侵入したウイルスのゲノム核酸を感知することで、抗ウイルス応答が活性化され、転写因子IRF3を介した抗ウイルス遺伝子発現が誘導されることで、ウイルス複製が抑制されると考えられてきました。しかしながら、ノックダウン細胞を用いた試験において、これらのウイルス応答性経路に関与するシグナル因子はウイルス複製をほとんど抑制していないことが判明しました。一方、転写因子であるインターフェロン制御因子1(IRF1)の発現を抑制した細胞株においてのみ、ウイルス複製量が顕著に上昇することを見出しました。IRF1はIRF3と同様に、ウイルス感染に応答して活性化することが知られていましたが、詳細な機能解析の結果、基底レベルで発現しているIRF1が、抗ウイルス因子の発現を恒常的に維持することで、ウイルス複製を強力に抑制していることを見出しました。さらにIRF1は肝炎ウイルスのみならず、病原フラビウイルスであるデング・ジカウイルスについても幅広く抑制する機能を持つことを明らかにしました。次にノックアウト細胞を作出しIRF1の標的遺伝子を探索したところ、これまでに抗ウイルス活性を持つことが知られていない脂質代謝酵素、免疫プロテアソーム構成分子やペプチダーゼ活性を持つ遺伝子を含む51の遺伝子群を同定し、複数の遺伝子がIRF1の抗ウイルスエフェクター分子として機能していることを明らかにしました。
この発見はIRF1を介した基底レベルの抗ウイルスシグナルが強力な抗ウイルス機能を持つことを示すと同時に、IRF1の下流で作用する遺伝子の中でも、幅広いウイルスに対して普遍的に抗ウイルス作用を発揮する遺伝子や、ウイルス特異的にのみ作用する遺伝子が存在することを明らかにしました。
3. 今後の展望
この研究により、IRF1による「基底レベル」で維持されている抗ウイルスシグナルが強力にウイルス複製を制御するという新たな仕組みを提唱しただけでなく、IRF1が転写制御する新たな抗ウイルス遺伝子群を多数同定しました。今後、同定された各遺伝子について作用機序を解明することにより、新たな作用機序を持つ抗ウイルス剤の開発に繋がることが期待されます。また、様々な株化細胞において強力なウイルス抑制作用を持つIRF1の機能をノックアウトすることにより、これまで細胞培養が困難であった病原体の培養システムの構築に寄与することが期待されます。
用語説明
- *:インターフェロン制御因子
- 抗ウイルス遺伝子の転写制御を司る転写因子。ヒト細胞においてはIRF1からIRF9という9つのファミリーが存在し、ISREやPRD-I、PRD-IIIと呼ばれる特定の宿主DNA配列に結合することで標的遺伝子の発現を誘導します。


