HOME > 広報活動 > 刊行物 > October 2014 No.015

October 2014 No.015
特集
研究紹介
開催報告
お知らせ・編集後記
特集
認知症、神経疾患克服への取り組み
東京都医学総合研究所 認知症・高次脳機能研究分野長長谷川 成人

はじめに
昨年12月イギリスのキャメロン首相の呼びかけで、主要8力国の世界認知症サミット(G8認知症サミット)が開催されて話題になりました。 世界の認知症患者数がおよそ3,560万人、2050年には3倍の1億1,540万に増えると予測されていることが背景にあります。 医学研でも認知症国家戦略に関する国際政策シンポジウムサミットなどを実施し認知症対策に取り組んでいますが、飛鳥井副所長と私の二人が英国大使館に招集され、G8サミットに向けた議論に参加しました。 世界的規模でその対策を真剣に考えなくてはいけない時がきていると実感しました。
認知症の種類と病態
認知症といってもその中身は様々ですが、アルツハイマー病、レビー小体型認知症、前頭側頭葉変性症などは、神経細胞が原因不明の代謝障害をおこして変性する有効な治療薬がない認知症です。
アルツハイマー病は記憶に関わる海馬や、感覚情報等を整理・統合して高次の判断を行う大脳皮質連合野の神経細胞が徐々に死んでいく病気で、神経細胞の中にタウと呼ばれるタンパク質が蓄積する異常を伴います。
一方、レビー小体型認知症は、手足の震えや歩行障害などに加え、「そこに人がいる」といったような幻視を見ることが多い認知症で、αシヌクレインというタンパク質が細胞内に蓄積します。また、前頭側頭葉変性症は、ヒト脳で最も発達している前頭葉が冒されることにより、性格が変わったり、自分勝手な行動をとったり、言葉の意味が分からなくなったりする病気で、TDP-43というタンパク質が細胞質内に蓄積するのが特徴です。
認知症の新しい考え方
ドイツの神経病理学者らの解析から、これらの異常タンパク質が蓄積する細胞で変性が強いこと、またその病変の広がりと症状の程度が強く相関することが示されていました。しかしながら、細胞の中の病変がどうして広がるのか、何らかのウイルスの関与を示唆する人はいましたが、深く考える研究者はいませんでした。なぜなら、細胞膜で包まれた大きなタンパク質分子がそれを突きぬけて他の細胞に移るということは科学者の常識では考えられないからです。私は今から10年ほど前、あることをきっかけに、その常識では考えられないことが病気で起こっているのでないかと考えました。「何かのきっかけで神経細胞の中に異常タンパク質が生じる。それが正常タンパク質を異常型に変換して増殖し、さらに異常型分子が神経回路などを伝わって他の細胞に広がる。病変分布の違いで症状の違いが生じ、病変が広がることで病気が進行する。」
神経細胞が変性する認知症は数ヶ月、数年単位で、確実に病状が進行、悪化しますが、異常タンパク質の伝播を考えるとそれが説明できます。
この考えはやはり科学者からはなかなか受け入れてもらえませんでした。しかし最近、動物実験でも実験的証拠が示され大きな注目を集めるようになってきました。
タンパク質が異常型に変換?
前述の「異常タンパク質が正常タンパク質を異常型に変換して増殖する」というのは、実はクロイツフェルト・ヤコブ病や牛海綿状脳症(BSE)の病原タンパク質「プリオン」で提唱された考えと同じです。 「プリオン」というのは、proteinaceousとinfectious を合成した用語で「タンパク質性感染因子」を意味します。 米国の神経学者、プルシナー博士が、タンパク質のみで自己増殖し、病気(感染)の原因となるという生物学の常識にない仮説を提唱し、その検証を行うことで1997年にノーベル生理学・医学賞を単独受賞しました。 プリオン仮説は、発表当初はもちろんのこと、ノーベル賞受賞後も、「プリオン説はほんとうか?」(ブルーバックス)で福岡伸一さんが述べていているように、検証が十分でないと批判されました。 1982年の仮説の提唱から32年経ったいま再び、アルツハイマー病などの認知症や多くの神経疾患の病態がこのプリオン説と同じ考えで説明できるという証拠が次々と報告されるようになりました。 しかも本家のプリオンの検証実験よりも明確に示されたのです。その実験(私達が行ったもの)をご紹介します。
図1:認知症患者に認められる異常病変
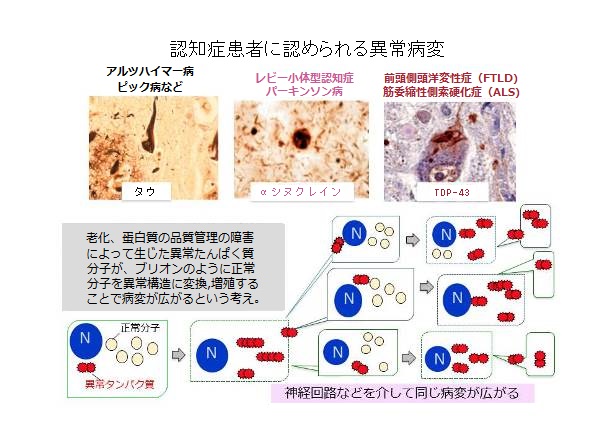
代表的な認知症の異常タンパク質病変(上段)と病態形成機序を説明する新しい考え方の模式図(下段)
検証実験
レビー小体型認知症はαシヌクレインというタンパク質が蓄積すると述べましたが、同じ病変を普通のマウスで再現することができていませんでした。 私達は大腸菌に作らせたヒトαシヌクレインを95%以上の純度に精製し、それをマウスの脳に注射するという単純な実験を行いました。正常型ヒトαシヌクレイン(線維化してない可溶性のもの)を注射してもマウスには何の変化もおこりませんでした。 ところが、試験管の中で一週間振とうして線維化し異常型に変化させたものを注射したところ、接種後たったの3ヶ月で患者にみられるものと同じ異常αシヌクレインの蓄積が観察されたのです1)。 さらにそれは時間経過と共に線維連絡を介して他の脳の部位に広がることも確認されました。次に接種したタンパク質自体が蓄積したのか、マウス脳の正常αシヌクレインが異常型に変化して蓄積したのかを特異抗体を用いて調べました。 その結果、注入したヒトαシヌクレインは約一週間で分解、消失し、その後1-3ヶ月でマウスの内在性αシヌクレインが異常型になって蓄積してくることが判明しました。 すなわち、ヒト異常型αシヌクレインをマウスの脳に接種するとマウスの内在性正常αシヌクレインが異常型に変化して蓄積することが実証されたのです。 また接種する場所を変えると全く違った広がりを示し、接種した場所と線維連絡のある場所に病変が出現すること、広がった場所に関連した症状が現れることも明らかとなりました2)。
プリオン病において検証が十分でないと先に述べましましたが、その理由はプリオンタンパク質が膜タンパク質で、大腸菌での大量調製や精製が難しく、病気の動物由来の脳試料を使わずに、試験管内で正常プリオンを異常型に変換することが困難だったからです。 一方、αシヌクレインは、大量発現、精製、試験管内変換が容易であったため、これが可能となりました。
私達はさらにレビー小体型認知症患者の剖検脳試料に存在する異常型αシヌクレインを野生型マウスの脳に接種する実験を実施し、同様に病変が出現することを世界で初めて示すことに成功して論文発表を行いました1) 。
図2:異常型αシヌクレイン接種実験の模式図(上段)とマウスの不活性αシヌクレインの解析(下段)
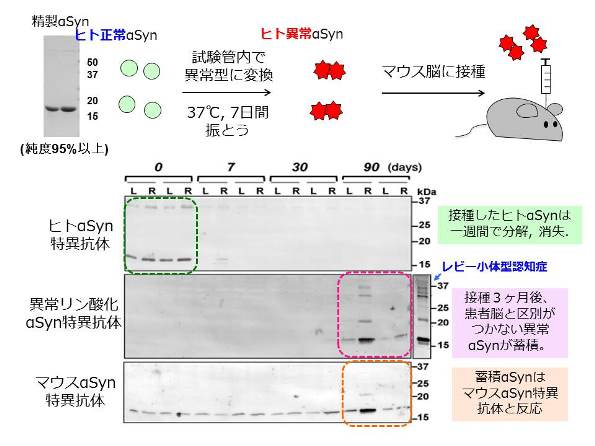
異常型αシヌクレイン接種実験の模式図(上段)とマウスの不溶性αシヌクレインの解析(下段)
接種後0、7、30、90日経過したマウスの脳に蓄積するαシヌクレインをヒトαシヌクレイン特異的抗体、異常リン酸化αシヌクレイン特異抗体、マウスαシヌクレイン特異抗体を用いて生化学解析した。
2匹ずつ、接種した右脳(R)と反対側の左脳(L)に分けて解析
プルシナー博士登場
私達が論文を発表して半年以上経った2013年11月、プルシナー博士の研究室から、私達の仕事と似た論文が権威ある米国科学アカデミー紀要に発表されました。 αシヌクレイン過剰発現マウスに多系統萎縮症(αシヌクレインが蓄積する病気)の脳試料を接種すると、異常型αシヌクレインの病変が早く出現し、運動機能が低下して死に至るという論文です。 実はプルシナー博士はプリオン説を提唱した際、プリオン病だけでなく、アルツハイマー病をはじめとする他の神経疾患も同様の機序で起こるのではないかという大胆な考えを述べていました。 しかしながら、サルに患者脳試料を接種する実験で発症がおこらなかったことから、この考えは否定されていました。 私達はプルシナー博士が研究室を挙げてこの仮説の再検討をはじめたと噂で聞いていましたが、自分たちと同じような論文を発表したのには驚きました。 もっとも私達が普通のマウスで実証したことを半年遅れで、しかも過剰発現マウスで再現した形ですので、自分たちの方がかなり先行しているという印象を持ちました。 しばらく後、プルシナー博士の秘書から「プルシナー博士がビジネスで日本に行くので、Breakfast meetingを行いたいが都合はどうか?」というメールが送られてきました。 田中所長に相談しましたところ、「滅多にあることではないのでしっかり準備をして行き、証拠写真を撮ってきなさい」と言われ、野中、鈴掛の二人の研究員を連れ立って行きました。 ホテルのレストランで朝食を食べながら議論するという本当の朝食会議でしたが、質問したいことや主張したいことを資料にして提示し、ストレートな議論ができました。 最後に資料のファイルを欲しいと言われて名刺を差し出されたのでサインを頼むと、丁寧に「Best of luck with your great work, Stan」と書いて下さいました。 短い時間でしたが大きな刺激となりました。

おわりに
以上のように、認知症の病原タンパク質が、異常な構造変化してプリオンのように正常分子を異常型に変換して脳内で広がる現象は、ほぼ実証されたといっても過言でないように思われます。 最初にどの細胞に、どんなタンパク質が、どのような構造変化を起こすかで、病変の広がりや変性する神経領域がかわり、症状の違いとなってあらわれる可能性が考えらます。 しかしながら、どうして細胞から細胞へ伝わるのかなど、未解決の問題があることも事実です。 今後、異常タンパク質が広がる機序を解明し、病気の進行を制御する治療薬、治療法開発を進めたいと考えています。
文献
- Masuda-Suzukake M, Nonaka T, Hosokawa M, Oikawa T, Arai T, Akiyama H, Mann DM, Hasegawa M. Prion-like spreading of pathological α-synuclein in brain. Brain. 136: 1128-38, 2013.
- Masuda-Suzukake M, Nonaka T, Hosokawa M, Kubo M, Shimozawa A, Akiyama H and Hasegawa M. Pathological alpha-synuclein propagates through neural networks. Acta Neuropathol Comm 2: 88, 2014.

