
HOME > 身近な医学研究情報 > 糖尿病合併症から身を守る
糖尿病合併症から身を守る
2.糖尿病の合併症(総論、眼合併症、腎症)
糖尿病の合併症(総論)
糖尿病の管理、すなわち「血糖コントロール」の主目的は、高血糖に伴う合併症を防ぐことにあります。合併症を大きく分けると、早急に手当を受けないと死に至る危険が高い急性合併症と、高血糖が持続することによって徐々に進行する慢性合併症があります(図5)。
図5.糖尿病による合併症
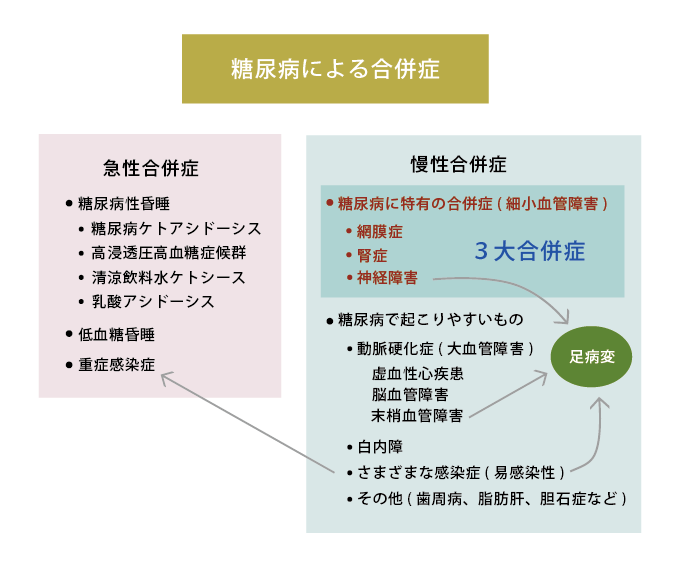
急性合併症
- 糖尿病性ケトアシドーシス:
- インスリン作用の絶対的欠乏によって起こる、全身代謝がうまく回らない状況です。1型糖尿病の発症に気付かず放置した場合や、インスリン注射をしている糖尿病患者が注射を中断した場合、何らかの原因で急激に高血糖状態になったときなどに起こります。極度の高血糖によって脱水や電解質の異常が生じます。またインスリンが極端に不足して、ブドウ糖をエネルギー源として利用できなくなり、それを代償しようとして脂肪の分解が進みます。脂肪分解過程で産生されたβ-ヒドロキシ酪酸、アセト酢酸、アセトン等のケトン体が血中に増えると、血液が酸性に傾き(アシドーシス)脳機能を障害します。
- 高浸透圧高血糖症候群:
- 2型糖尿病の高齢者に多く、著しい高血糖(通常800 mg/dL以上、時に2,000 mg/dL)に高度の脱水を伴います。インスリンの分泌はある程度保たれケトン体の増加も顕著ではありませんが、血清浸透圧が上昇することによって意識障害をきたします。高齢者では体水分量の減少や腎機能の低下により水・電解質バランスが崩れやすい状態にあるうえ、脱水に伴う喉の渇きも感じにくくなっています。そのため発見が遅れて重篤な昏睡状態に陥るケースが多く、早急で的確な診断・治療が必要です。
- 清涼飲料水ケトーシス:
- ペットボトル症候群ともいわれ、青年期の高度肥満男性に多くみられます。本来であれば軽度な糖尿病の人が、糖尿病の病識がなく多量のショ糖を含む清涼飲料水を飲用し、高血糖による口渇をさらに清涼飲料水で癒そうとして著しい高血糖を招くという発生機序が考えられています。この背景には日本人のライフスタイルの変化、特に若者の食行動の変化があると言えます。
- 乳酸アシドーシス:
- 体内に乳酸が蓄積することによってアシドーシスが起こります。アルコールの大量摂取が原因として多く、死亡率が極めて高い予後不良の合併症です。その他の原因としては低酸素などが挙げられますが、高血糖自体も乳酸アシドーシスになりやすい状態と考えられています。1950年代後半にビグアナイド製剤であるフェンホルミンの副作用で乳酸アシドーシスの発生が相次ぎました。現在使用されているビグアナイド製剤のメトホルミンでは、そのリスクは低いと言われていますが、高齢者、腎・肝・心・肺機能障害のある方、手術前後の方、アルコール多飲者では、注意して使用する必要があります。
- 低血糖:
- 内服薬やインスリン注射は血糖値を下げますが、やはり副作用として低血糖が出現することがあります。通常、血糖値55 mg/dL程度まで下がると発汗や震え、頻脈や蒼白、不安感などの自律神経系の症状(警告症状)が出現します。血糖値50 mg/dL程度まで低下すると、頭痛や眠気、けいれんや昏睡など、中枢神経の症状が出現します。しかし、糖尿病の罹病期間が長かったり、低血糖を何度も経験したり、血糖コントロールが不良であったりすると、上記の警告症状がなく、中枢神経症状が最初に出現する場合があります(無自覚性低血糖)。その場合重症低血糖になり意識を失う可能性もあり、注意が必要です。
慢性合併症
高血糖状態に長期間さらされることにより、ほぼ全身の臓器・組織が何らかの障害をうけます。なかでも糖尿病に特有の合併症として網膜症、腎症、神経障害があり、糖尿病の3大合併症といわれます。網膜症は失明の原疾患として緑内障に次いで第2位、腎症は人工透析導入の原疾患として第1位を占めています。神経障害は足のしびれや痛み、排尿・便通異常等の多彩な症状で患者に苦痛を与えます。また神経障害がすすむと足先の感覚が鈍くなり、やけどやケガをしても気付かないことがあります。これに動脈硬化(足先の血流が低下する)や感染などが加わると足の病変(潰瘍や壊疽)が起こりやすくなり、切断を余儀なくされる状態まで悪化してしまうことも少なくありません。交通事故などの外傷を別にすると、足切断の原因として最も多いのは糖尿病です。さらに、糖尿病患者では心臓や脳を栄養する血管にも動脈硬化が進行しており、虚血性心疾患(心筋梗塞、狭心症等)や脳梗塞の発症頻度が高くなります。
慢性合併症の成因
これらの慢性合併症が起こる原因として、高血糖に基づく代謝異常や血流の障害が指摘されていますが、その具体的なメカニズムについては未だに明らかでない点が多く残されています。血流の障害も代謝異常に起因するもので、特に細小動脈や毛細血管などの細い血管がおかされやすく、細小血管障害と呼ばれます。網膜症や腎症は、神経障害に比べて血管病変の関与がより強いとされています。
筋肉や脂肪組織では、血中から細胞内へのブドウ糖取り込みがインスリンによって調節されています。糖尿病ではインスリンの作用不足から、これらの組織での糖取り込み・利用が障害されます。これに対して合併症の起こりやすい組織(網膜、水晶体、腎臓、末梢神経等)では、ブドウ糖の取り込みにインスリンは深く関与せず、糖濃度に依存すると考えられています。つまり血糖値が高いとそれに応じて細胞内へのブドウ糖流入が増える、というわけです。過剰に取り込まれたブドウ糖が以下に示すような種々の代謝異常に関与することによって、細胞や組織にダメージを与え機能障害を引き起こすことが示唆されています。
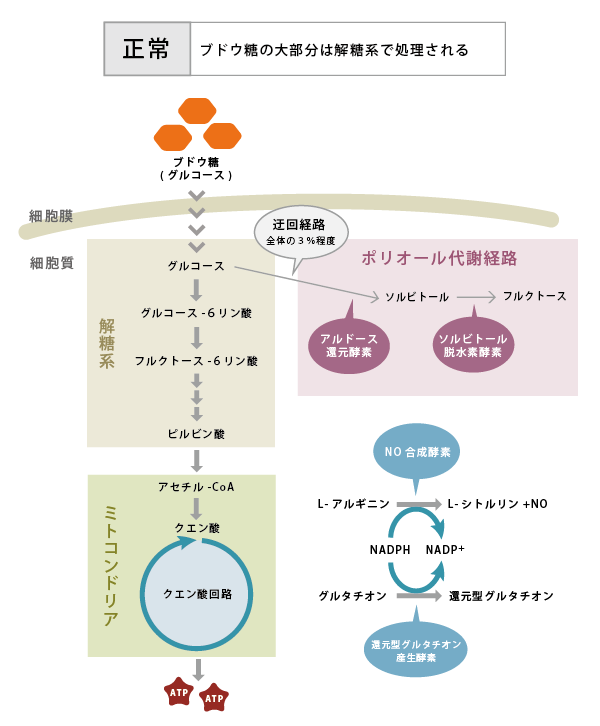
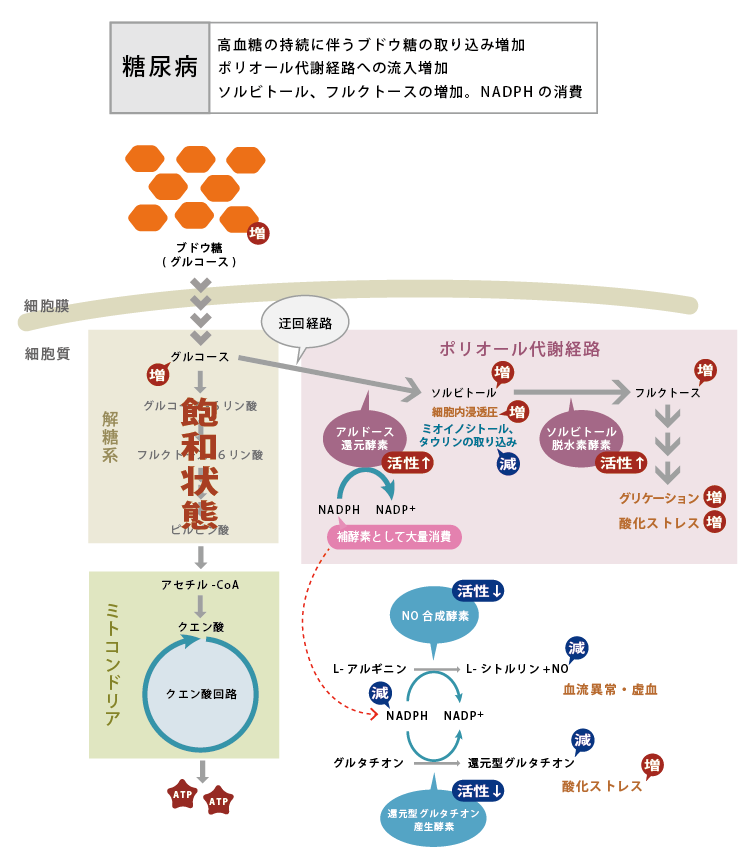
- ポリオール代謝亢進:
- 細胞内に取り込まれたブドウ糖の多くは、解糖系からクエン酸回路に入り、ATPの産生に利用されます。高血糖に伴い取り込まれるブドウ糖の量が増えると、解糖系経路だけでは処理しきれなくなり、迂回経路を通るようになります。その一つがポリオール代謝経路(図6)で、ブドウ糖はアルドース還元酵素 (Aldose reductase (AR))によってソルビトールへと変換されます。ソルビトールは細胞内の浸透圧を上昇させるとともに、細胞内情報伝達に重要なミオイノシトール、タウリンなどの取り込みを阻害します。またARの活性が上昇することによって、補酵素であるNADPH(還元型ニコチンアミドアデニンジヌクレオチド燐酸)が大量に消費されます。一酸化窒素(NO)合成酵素や還元型グルタチオン産生酵素もNADPHを補酵素として利用するため、NADPHの減少によってこれらの酵素の働きが阻害され、NOや還元型グルタチオンの合成が低下します。NOの低下は血流の異常や虚血を、還元型グルタチオンの減少は酸化ストレスの亢進を招くと考えられています。さらに、ソルビトールはソルビトール脱水素酵素 (Sorbitol dehydrogenase (SDH))によってフルクトース(果糖)に変換されます。フルクトースならびにその代謝産物は、次に述べる糖化(グリケーション)や酸化ストレスに関与することが報告されています。
図6. 糖尿病によるポリオール代謝亢進
- 糖化(グリケーション):
- 過剰の糖が酵素の触媒を介さずにタンパク質と結合してしまう現象で、非酵素的糖化ともいいます。グリコヘモグロビンは典型的な糖化タンパクですが、他の血中タンパクや細胞成分、細胞間物質等も糖化による修飾を受けます。糖化タンパクは細胞の構造や機能を障害するとともに、フリーラジカルという不安定な分子を発生させます。さらに糖化タンパク同士で架橋を形成して、不溶性の大分子である後期糖化最終産物(advanced glycation end-products: AGE)を作ります。AGEは血管内皮細胞やマクロファージ等の表面にあるAGE受容体(receptor for AGE: RAGE)に結合し、サイトカインや活性酸素の産生を刺激することによって細小血管障害の進展に関与すると考えられています。最近では糖尿病のみならず、動脈硬化症、認知症、非アルコール性脂肪肝炎 (NASH)などの病態にも、AGEの組織内蓄積やRAGEとの結合が関与しているとの報告があります。
- プロテインキナーゼC (PKC) 活性異常:
- PKCは種々の細胞内情報伝達に重要な役割を担っているタンパク燐酸化酵素です。構造や生化学的性質の違いに基づいて多くの型(アイソフォーム)に分類されていますが、糖尿病状態では網膜、腎臓、心臓、大動脈などの組織においてPKC-βアイソフォームが活性化されることがわかってきました。活性化PKC-βはさまざまなシグナル伝達系を介して血流異常や血管新生を引き起こし、網膜症や腎症の進行に関与すると考えられています。神経組織ではPKC-αアイソフォームの活性低下とともに神経内細小血管におけるPKC-βの活性亢進が報告されています。
- 酸化ストレス:
- 細胞内に取り込まれた酸素(O2)の代謝過程で生じる、反応性の高い分子を活性酸素と呼びます。スーパーオキサイド(O2-)、ヒドロキシラジカル(OH)のようなフリーラジカルや過酸化水素(H2O2)などが活性酸素に含まれます。生体内で過剰となった活性酸素は、DNA、タンパク質、膜脂質などに傷害を与えます。この酸化ストレスの増加は、糖尿病だけでなく老化、がん、アルツハイマー病などの成因としても注目されています。高血糖による酸化ストレス亢進の原因として、ブドウ糖の自己酸化、ポリオール代謝亢進による還元型グルタチオンの減少、糖化による抗酸化酵素の活性低下、PKC活性異常などが密接に関連しているものと考えられています。
- 成因に基づいた治療薬の開発:
- 1992年に我が国で臨床応用が開始されたAR阻害薬(エパルレスタット)は、初期の糖尿病神経障害患者を対象に処方されています。2006年の報告では、血糖コントロールが良好な患者群においてエパルレスタットの効果がより顕著である、という結果が示されました。ポリオール代謝経路は他の合併症成因の起点となることを示唆する報告も多く、AR阻害薬によるポリオール経路の抑制は、高血糖に起因する幅広い代謝異常を是正すると考えられています。また抗酸化作用を持つビタミンEや、血流を改善させるプロスタグランジン製剤、血管拡張薬、抗凝固薬等の有用性も報告されています。さらに現在、AGE阻害薬、PKC-β阻害薬、抗酸化薬、抗サイトカイン薬等の開発が進められています。厳しい食事療法を続けなくても合併症の進行を防ぐことができる薬が開発されれば、糖尿病患者さんにとって理想的といえます。しかし残念ながら、当面は血糖の管理を主体とした食事療法、運動療法に頼らざるを得ない状況です。
糖尿病眼合併症
目は糖尿病の影響を受けやすい器官です(図7)。糖尿病に特有の合併症として網膜症と新生血管緑内障が、糖尿病があると進みやすいものとして白内障があります。
図7. マウス眼球の構造(写真提供:東京都医学総合研究所 病院等連携支援センター 原田高幸センター長)
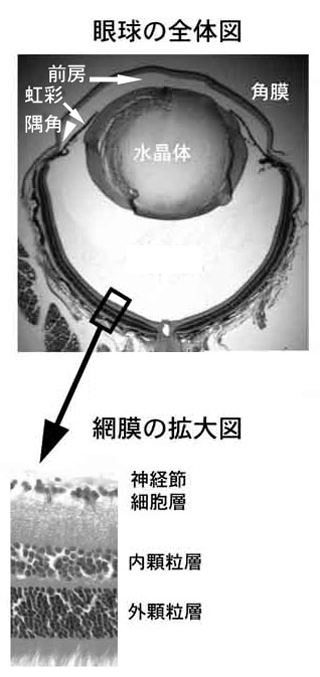
眼球の断面図を上段に、網膜の微細構造を下段に示してある。眼球をカメラにたとえると、水晶体はレンズ、虹彩は絞り、網膜はフィルムに相当する。眼球内に入ってきた光は網膜(10層からなる)で電気信号に変換され、視神経を介して脳(視覚中枢)に伝えられる。高血糖が持続すると網膜に分布する毛細血管がおかされ、網膜症が起こってくる。網膜症が進行して虹彩に新生血管が生じると、隅角が詰まり眼圧が上昇する(新生血管緑内障)。水晶体ではソルビトールの蓄積やタンパクの糖化などによって、白内障が起こりやすくなる(詳しくは本文参照)。
糖尿病網膜症
2型糖尿病と診断されたときには、既に網膜症が20%存在し、糖尿病の発症後20年間で、1型糖尿病の100%、2型糖尿病の60%の患者に網膜症が発症すると言われています。糖尿病網膜症は、日本では中途失明の原因として、2019年の調査で緑内障、網膜色素変性症に次いで3位となっています。とはいえ、糖尿病網膜症による失明人数は年間約3,000人に上るとも言われ、視覚障害をきたす主要な疾患であることに変わりはありません。しかし適切な時期に治療を受けることで、失明という最悪の事態は避けられます。自覚症状はなくても定期的に眼科で眼底検査を受けましょう。特に血糖値が高い状態が続いた場合、急激に血糖値を下げると網膜症が悪化することがありますので、糖尿病健康手帳(日本糖尿病協会編)や糖尿病眼手帳(日本糖尿病眼学会編)などを利用して内科医と眼科医の連絡を密にとることが必要です。
網膜症は進行状態によって、単純網膜症、増殖前網膜症、増殖網膜症の3段階に分けられます。
- 単純網膜症:
- 網膜の毛細血管が弱くなり、血管壁が膨れて小さなコブ(毛細血管瘤)ができます。また血管が破れて小さな出血が起き、血清成分が網膜上に沈着してシミ(硬性白斑)ができます。病変は網膜内に限局し自覚症状もありませんが、この段階で発見し血糖コントロールをしっかり行えば網膜症を治すことも可能です。
- 増殖前網膜症:
- 血糖コントロールを怠り単純網膜症を放置しておくと細い血管が詰まり始め、血流が低下した領域の神経組織は酸素や栄養の供給不足から壊死に陥ります。壊死した神経組織は眼底検査で小さな白いシミ(軟性白斑)として観察されます。病変は網膜内ですが活動性が高く、完全に治すことはできません。この段階では、血糖コントロールに加えてレーザー光凝固が網膜症の進行を抑えるのに有効です。血流不足に陥っている部位にレーザーを照射して間引き、残った細胞に酸素を集中させます。
- 増殖網膜症:
- 血管の閉塞が広範囲に及ぶと、酸素不足を補おうとして新しい血管(新生血管)が発生し、網膜の表面や硝子体へ伸びていきます。新生血管はもろく破れやすいので、網膜前出血や硝子体出血を引き起こし急激な視力低下がみられます(図8)。またこの段階へ進むと網膜剥離や新生血管緑内障(次項)を起こしやすくなり、失明の危険が高くなります。増殖網膜症に対しては、硝子体手術という外科治療が有効な場合があります。眼球内を照らす照明ファイバーを用いて、出血部を吸引したり剥離した網膜を元に戻したりする手術です。近年、手術器具の改良や術式の進歩によって、視力が改善し失明を免れる患者さんが増えてきました。
図8.増殖網膜症の眼底写真(徳島大学眼科 三田村佳典教授の御協力による)
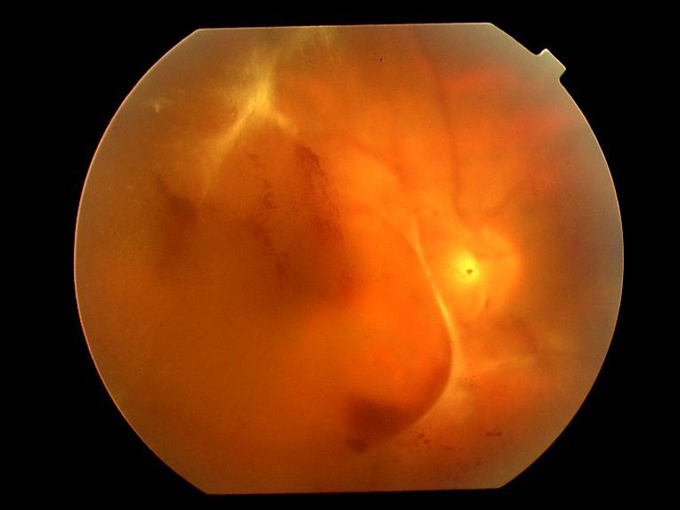
新生血管が破れ、出血が広い範囲に及んでいる
白内障・緑内障
- 白内障:
- 白内障は目のレンズ(水晶体)が濁る病気で老化現象の一つですが、糖尿病患者では発症時期が早まる傾向にあります。水晶体のクリスタリンというタンパク質の糖化や、ポリオール代謝の亢進によるソルビトールの蓄積が白内障の発症に深く関与すると考えられています。
- 新生血管緑内障:
- 眼球の中には房水という液体が流れ、眼圧を一定に保っています。糖尿病網膜症が進行すると、虹彩(カメラの絞りに相当する部位)に新生血管が生じ、房水の排出口である隅角がつまってしまいます。このため眼圧が上昇し、視神経が圧迫されて視力が低下したり視野が狭まっていきます。
糖尿病腎症
腎臓の主たる機能は、血液をろ過して老廃物を除去し尿から体外へと排出させることです。腎不全はこの血液ろ過機能が損なわれた状態で、老廃物が体内にたまって尿毒症をおこすと死に至ります。人工透析をして血液をろ過する必要が生じるわけです。2007年の統計によると、我が国では年間約16,000人の糖尿病患者が腎症の進行によって腎不全に陥り、慢性透析療法が導入されています。これは全透析導入患者の約4割を占めており、原因疾患の第1位となっています。腎症の発症には、糖尿病の罹病期間や血糖コントロールの状況に加え、「腎症になりやすい遺伝子」の関与が示唆されています。
腎症は進行状況によって、腎症前期、早期腎症期、顕性腎症期、腎不全期、透析療法期の5段階に分けられます(図9)。網膜症と同様に、より早期の段階で発見し適切な治療をおこなえば、腎不全という最悪の事態は回避できます。
図9.糖尿病腎症の病期分類と各病期における対策
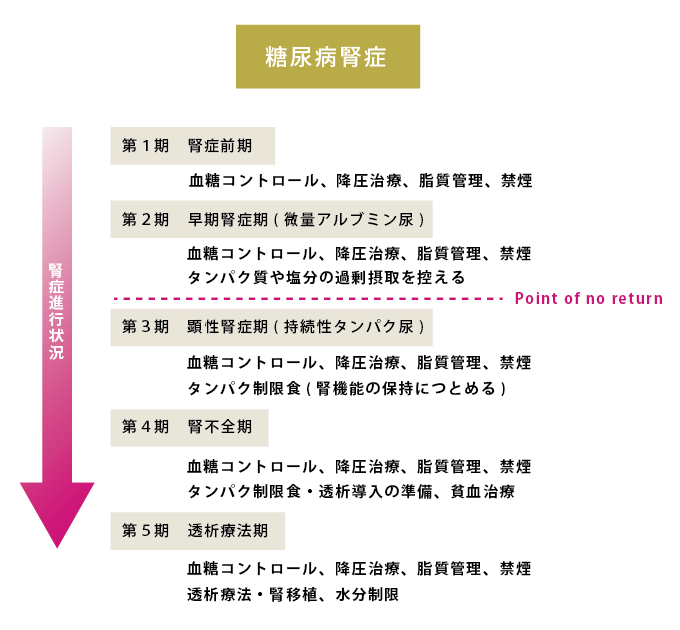
- 第1期(腎症前期):
- 腎症の潜在期で、自覚症状はなく検査値も正常範囲内です。治療は血糖コントロールが中心です。
- 第2期(早期腎症期):
- 自覚症状はなく検査値も正常範囲内ですが、微量アルブミン尿がみられます。アルブミンは血中に含まれるタンパクの一種ですが、腎機能の障害が進むと尿中に漏れ出てきます。通常の尿検査ではわかりませんが、尿中アルブミン検査を定期的に実施することで発見できます。この段階で厳格な血糖および血圧のコントロールをおこなえば、腎症の進行を阻止できます。降圧薬としては、アンジオテンシン受容体拮抗薬やアンジオテンシン変換酵素阻害薬が腎保護作用をもつことが証明されています。また腎臓への負担を少なくするために、タンパク質や塩分の過剰摂取を控えたほうが良いでしょう。近年、1型糖尿病、2型糖尿病の両者において、早期腎症期に適切な治療を行うことで6年間に50~60%の症例でアルブミン尿の陰性化がみられたと報告されています。
- 第3期(顕性腎症期):
- 尿検査で持続的にタンパク尿が検出されるようになります。さらに進行すると、血圧が上昇したり、足にむくみ(浮腫)がみられたりするようになります。この段階に至ると、血糖コントロールのみによる腎症の進行阻止は期待できません。塩分制限とタンパク制限食に重点を置いて、腎機能の保持につとめます。
- 第4期(腎不全期):
- 腎機能の低下がさらに顕著となり、貧血、浮腫、全身倦怠感などの症状がみられます。厳格な塩分制限と食事療法(低タンパク食)を進めるとともに、透析導入の時期について検討します。また、状況に応じ、水分制限も行います。
- 第5期(透析療法期):
- 腎不全による尿毒症を避けるために、人工透析(血液透析や腹膜透析)を導入します。最近では在宅透析などの選択肢もありますが、病院で行う血液透析は週3回、1回に4〜5時間を要するため “生活の質(Quality of Life)”低下が著しく、精神的な苦痛も伴います。また糖尿病から腎不全に至った場合、動脈硬化や自律神経障害も進行しているため血圧低下などの透析中の合併症を起こしやすく、5年後の生存率は50%程度と予後も悪くなっています。
最近では、このような典型的な経過をたどる糖尿病腎症に加え、タンパク尿が陰性のまま腎不全が進行する高齢の患者さんが増えています。動脈硬化が進行して腎臓全体の機能が低下しますが、アルブミンなどのタンパクを再吸収する糸球体は壊れないため、タンパクが尿に出ないことが原因と考えられています。タンパク尿を伴わないケースを含めて、糖尿病が原因で起こる腎臓病全体を「糖尿病性腎臓病」と呼ぶようになりました。タンパク尿が陰性であっても、定期的に体重や血圧をチェックし、血液検査で腎機能を評価しておくことが重要です。

