HOME > 広報活動 > 刊行物 > April 2016 No.021

April 2016 No.021
特集
研究紹介
開催報告
編集後記
特集
iPS細胞のゲノム編集による疾患の 治療法の開発
再生医療プロジェクトリーダー宮岡 佑一郎

iPS細胞が広げる再生医療の可能性
私達の身体をつくる多種多様な細胞は、たった一つの受精卵が分裂を繰り返して生み出されます。ある細胞が特定の細胞種に変化していくことを分化といい、どんな細胞種にも分化できる能力を分化多能性といいます。分化多能性は、受精卵から生み出された細胞が分化し、それぞれの個性と機能を獲得するにつれて失われていきます。しかし、その常識を覆したのが山中伸弥先生らのiPS細胞(induced pluripotent stem cell、人工多能性幹細胞)です。iPS細胞技術は、遺伝子の力を借りて一度分化してしまった細胞を、分化多能性を持つ細胞へと戻します。したがって、皮膚の細胞からiPS細胞を作製し、さらにそのiPS細胞を心臓の細胞へ分化させるといったことも可能になりました。iPS細胞を使うことで、患者さん自身の細胞を使った移植治療や、疾患を培養皿中で再現することによる創薬など、再生医療の可能性は大きく広がりました(図1)。
図1.iPS細胞が広げる再生医療の可能性
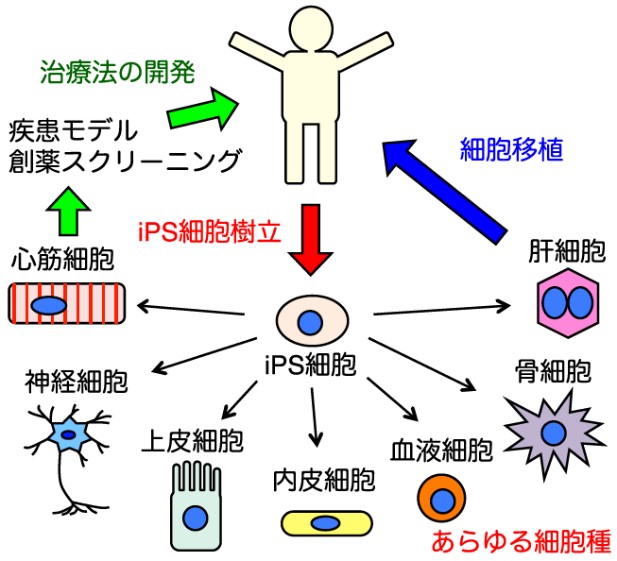
iPS細胞の遺伝情報を操作できれば…
2014年には理化学研究所などのグループが、世界初となるiPS細胞由来の細胞の移植手術を行い、細胞移植治療の可能性は高まっています。しかし、遺伝病の場合はその原因となる変異が患者さんの遺伝情報の中に最初から含まれているため、患者さんから作製したiPS細胞も同じ変異を持ちます。したがって、この細胞を移植してもまた同じ問題が起きてしまうと考えられます。
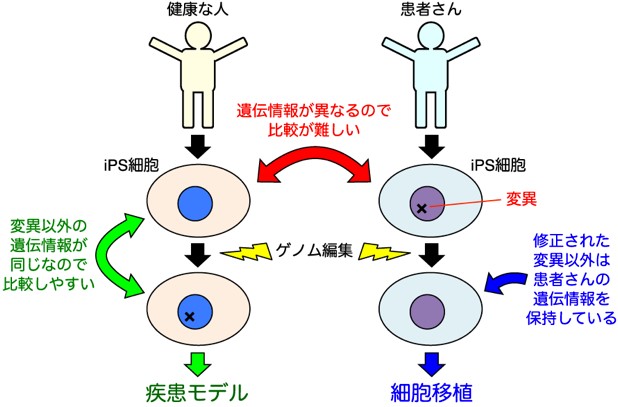
また、iPS細胞を使って培養皿中で病気を再現する研究も盛んに進められています。遺伝病研究ではこれまで、変異を持つ患者さん由来のiPS細胞と、変異を持たない健康な人由来のiPS細胞を比較してきました。しかし、人はたとえ親子でも持っている遺伝情報が異なります。みなさんは小学校で「対照実験」を習ったのを覚えているでしょうか。ある条件の差(この場合は変異の有無)によってもたらされる結果の差(この場合は細胞が病気のようになるか)を比較し、もともとの条件の差が持つ効果を調べる実験です。ある変異の効果を調べたいときは、その変異の有無以外は全く同じ条件の細胞を比較すべきですが、人はそれぞれ持つ遺伝情報が異なるため、そのようなiPS細胞を得ることはできませんでした。つまり、小学校で習う対照実験を、私達本職の研究者でも厳密には行えなかったのです(図2)。
こうした問題は、iPS細胞の遺伝情報を操作できれば解決するのですが、そのような技術はなかなか実現しませんでした。
ゲノム編集技術の発展
iPS細胞は生命科学における革命でした。それは、2006年の発表からわずか6年後の2012年に山中先生がノーベル賞を受賞されたことからも明らかです。奇しくもこの2012年に、生命科学にもう一つの革命が起こりました。ゲノム編集技術の発展です。ゲノム編集技術は、私達の細胞の中にある遺伝情報の好きな部分を選んで操作できる技術です。この技術は瞬く間に世界中に広がり、iPS細胞と同様に数年の間のノーベル賞が確実視されています。この技術こそが私達が待ち望んだ、iPS細胞の遺伝情報の操作を可能にするものでした(図2)。
図2.iPS細胞のゲノム編集による研究
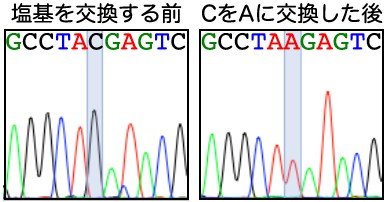
30億塩基の中の1塩基だけを交換する
遺伝情報は細胞の中のDNAという物質にあります。DNAはアデニン(A), チミン(T), グアニン(G), シトシン(C)という4種類の塩基が紐のように一列に繋がった構造をしています。この4種類の塩基がどのような順番で並ぶかで、遺伝情報を細胞に伝えます。いわば、4種類の文字を使って、暗号のように細胞の設計図が作製されているようなものです。人の全ての遺伝情報(ゲノムといいます)はこの塩基が30億個集まって構成されています。多くの病気は、この30億個のうちたった1つが、例えばCからAに代わってしまうことで起こります。しかし、上述のゲノム編集技術を使っても、30億個もある塩基中のたった1つの塩基の交換を行うのは非常に困難でした。私達は、ゲノム編集技術に加えて、デジタルPCR※と呼ばれる最新の技術などを駆使することで、この難問を解決し30億塩基の中のねらった1塩基だけの交換を可能にしました(図3)。
図3.iPS細胞のCからAの1塩基交換による疾患モデル細胞の作製
肝臓病の細胞移植治療法を開発する
再生医療プロジェクトでは、私達の開発した技術によって、患者さん由来のiPS細胞の変異を修正し移植に用いる治療法の開発を目指しています。そのために肝臓の遺伝病であるウィルソン病を標的として研究を進めています。ウィルソン病では、肝臓の細胞から不要な銅を排出するポンプの役割を果たすATP7Bという遺伝子に変異が起き、体内に銅が蓄積してしまいます。私達は、ATP7Bに1塩基の交換が起きてしまっているiPS細胞の変異を元の配列に戻すための最も正確で効率のよい方法を開発しています。
心臓病の発症の仕組みを解明する
再生医療プロジェクトではさらに、健康な人由来のiPS細胞に、心臓病の原因となる1塩基の交換を導入することで、病気の心臓で起きていることを培養皿の中で再現し、治療法の開発につなげる研究も進めています。例えば、RBM20という遺伝子の変異をiPS細胞に導入し、心臓の筋肉の細胞に分化させると、患者さんで起きているのと同じ細胞の異常が観察されました(図4)。したがって、この細胞を解析すれば心臓病発症の仕組みを分子レベルで解明することができ、患者さんから細胞を提供してもらう必要もなくなります。
再生医療プロジェクトではこのように、iPS細胞とゲノム編集技術を組み合わせることによって、疾患の新たな治療法の開発を目指しています。
図4
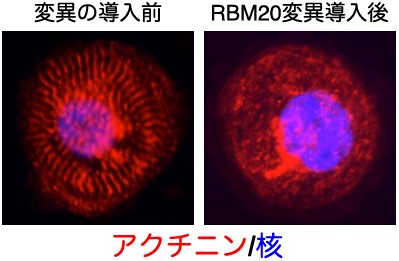
図4.RBM20の変異を導入したiPS細胞由来の心臓の筋肉の細胞 筋肉の収縮のために必要な縞状のサルコメアという構造をアクチニン(赤色)というたんぱく質と細胞の核(青色)を可視化することで観察した。変異を導入した細胞ではサルコメアが正しく形成されなかった。
人とのつながりを活力に
私は2011年から2015年まで米国サンフランシスコにある、グラッドストーン研究所のConklin博士の研究室で博士の薫陶を受けました。山中伸弥先生も、同研究所に留学され、現在は研究室を運営されています。そのため、Conklin博士と山中先生は昔からの友人で、Conklin博士を介して私も山中先生から直接多くのことを学ぶ機会をいただきました。また山中先生とともにiPS細胞を開発した高橋和利博士や米国の山中先生の研究室を立ち上げた友田紀一郎博士とも知り合うことができました。とても貴重な経験になったと感謝しています。英語は敬語もありませんので、留学中は「シンヤ」と山中先生の名前を呼び捨てにしていましたが、日本では姿勢を改めなくてはと、襟を正しているところです。
上述の2012年のゲノム編集技術の革命は、アメリカから発信されました。その研究の進展の勢いたるや、凄まじいものがあります。大きく分けてアメリカ西海岸のグループと東海岸のグループが激しい競争をしながら研究が進んでいるというのも一つの理由だと思います。どちらが特許を取得するのか、ノーベル賞は…デッドヒートはまだまだ続いています。私は両グループの研究者を間近で見たり話したりする機会を得て、大きな刺激を受けました。私も、1塩基を交換する手法で研究の発展に多少は貢献できたことを嬉しく思いますし、今後もさらに独自の研究成果を発信すると心に誓っています。
再生医療プロジェクトは、2016年1月より始まりました。このような貴重な機会を与えてくださったみなさんに感謝し、都民の方々に研究成果を還元できるように研究に邁進してまいります。
【用語解説】
- ※デジタルPCR:
- 1つ1つのDNA分子の複製を繰り返し、数を増やすことで詳細にその塩基の並びを調べる方法。


