2025年10月16日
認知症研究プロジェクトの野中隆プロジェクトリーダーらは、共同研究により「アルツハイマー病の鍵を握る“可逆的な前駆体”を発見―タウ凝集予防の新たな標的―」について Neuroscience Research に発表しました。
アルツハイマー病の鍵を握る“可逆的な前駆体”を発見
―タウ凝集予防の新たな標的―
アルツハイマー病(注1)は、脳内でタウタンパク質(注2)が異常に凝集して線維をつくり、神経細胞を破壊することで発症することが知られています。しかし、このタウタンパク質の凝集がどのように始まるのか、特に初期段階のしくみはこれまで十分に解明されていませんでした。東京都立大学大学院理学研究科の高橋知未(博士後期課程)・栗田玲 教授の研究グループは、当研究所・野中隆 認知症研究プロジェクトリーダー、東京大学大学院薬学系研究科・富田泰輔 教授らとの共同研究により、タウタンパク質が線維化する前に数十nmの大きさを持つ巨大な「前駆体クラスター(注3)」を形成することを明らかにしました。このクラスターは、最終的に形成される線維とは異なり、壊すことが可能な「可逆的」な構造であることが特徴です。実際に、塩化ナトリウム(NaCl)を加えると前駆体クラスターが壊され、線維化が抑えられることを示しました。
この成果は、アルツハイマー病の進行を左右する重要な「初期の可逆段階」を初めて捉えたものです。今後、このクラスターを標的とすることで、発症予防や進行抑制につながる新しい治療戦略の開発が期待されます。
■ 本研究成果は、10月8日付け(日本時間)でElsevierが発行する英文誌 Neuroscience Researchに発表されました。本研究の一部は、学術振興会科学研究費補助金(20H01874、22K07362、25K21773、24H00624、22H05036、 23K21357、25K02405、23H00394、23KK0133)日本医療研究開発機構AMED (24wm0625303)JST SPRING(JPMJSP2156)の支援を受けて行われました。
論文情報
- <論文名>
- “Hindering Tau Fibrillization by Disrupting Transient Precursor Clusters”
- <著者>
- Tomomi Takahashi, Takashi Nonaka, Reiko Ohtani, Masato Hasegawa, Yukiko Hori, Taisuke Tomita, and Rei Kurita
- <掲載誌>
- Neuroscience Research
DOI:10.1016/j.neures.2025.104968
URL:https://doi.org/10.1016/j.neures.2025.104968
ポイント
- タウタンパク質の異常凝集の初期段階で巨大な前駆体クラスターが形成される。
- 前駆体クラスターは線維とは異なり、破壊可能な可逆的な構造である。
- 前駆体クラスターが壊されると、線維化が著しく遅くなる。
- この前駆体クラスターをターゲットとすることで、タウタンパク質の線維化を抑制し、アルツハイマー病の発症予防が期待できる。
研究の背景
アルツハイマー病は、記憶や認知機能が徐々に失われていく代表的な神経変性疾患で、世界的に患者数が増加しています。病気の脳には大きく二つの特徴的な変化が見られます。一つはアミロイドβが固まってできる「老人斑」、もう一つはタウタンパク質が線維化して神経細胞の中に蓄積する「神経原線維変化」です。
これまで多くの研究はアミロイドβに注目し、凝集のしくみや中間体を標的とした薬の開発が進められてきました。一方で、タウタンパク質の線維化は認知症の発症前から進行することが知られており、アミロイドβだけでなくタウタンパク質を直接抑える治療戦略が求められています。
タウタンパク質は「天然変性タンパク質(注4)」と呼ばれる、柔軟で形が定まらない分子であり、同じような性質を持つαシヌクレインやTDP-43もパーキンソン病やALSなどの病気に関わっています。これらのタンパク質がどのように秩序だった線維へと変化するのかは、物理学的にも重要な未解明の課題でした。
研究の詳細
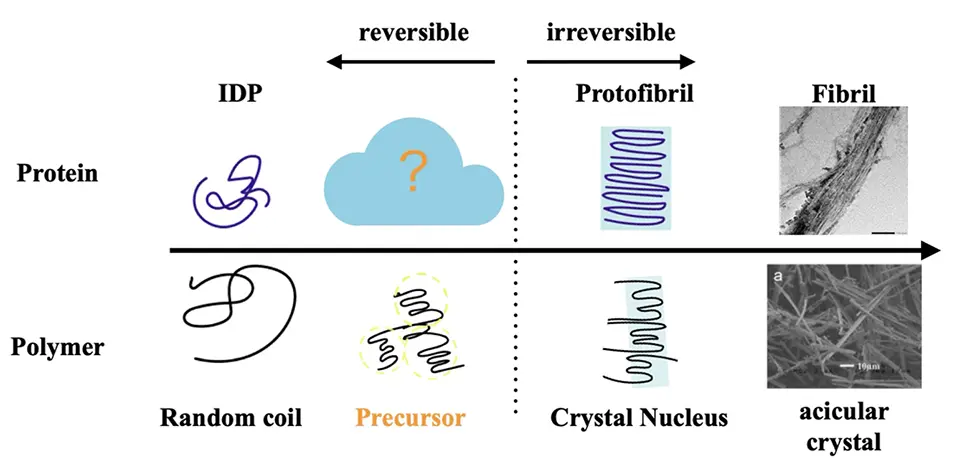
私たちの研究グループは、タウタンパク質の凝集を理解するために「高分子物理」の視点を導入しました。高分子結晶の研究では、無秩序な鎖状分子が結晶になる際に「前駆体(プレカーサー)」と呼ばれる中間的な状態を経由することが知られています。この前駆体は結晶化の進み方や最終的な構造を決定づける重要な存在であり、物性物理学の分野では広く受け入れられた概念です。私たちは、同じような物理法則が「天然変性タンパク質」であるタウの線維化にも当てはまるのではないかと考えました(図1)
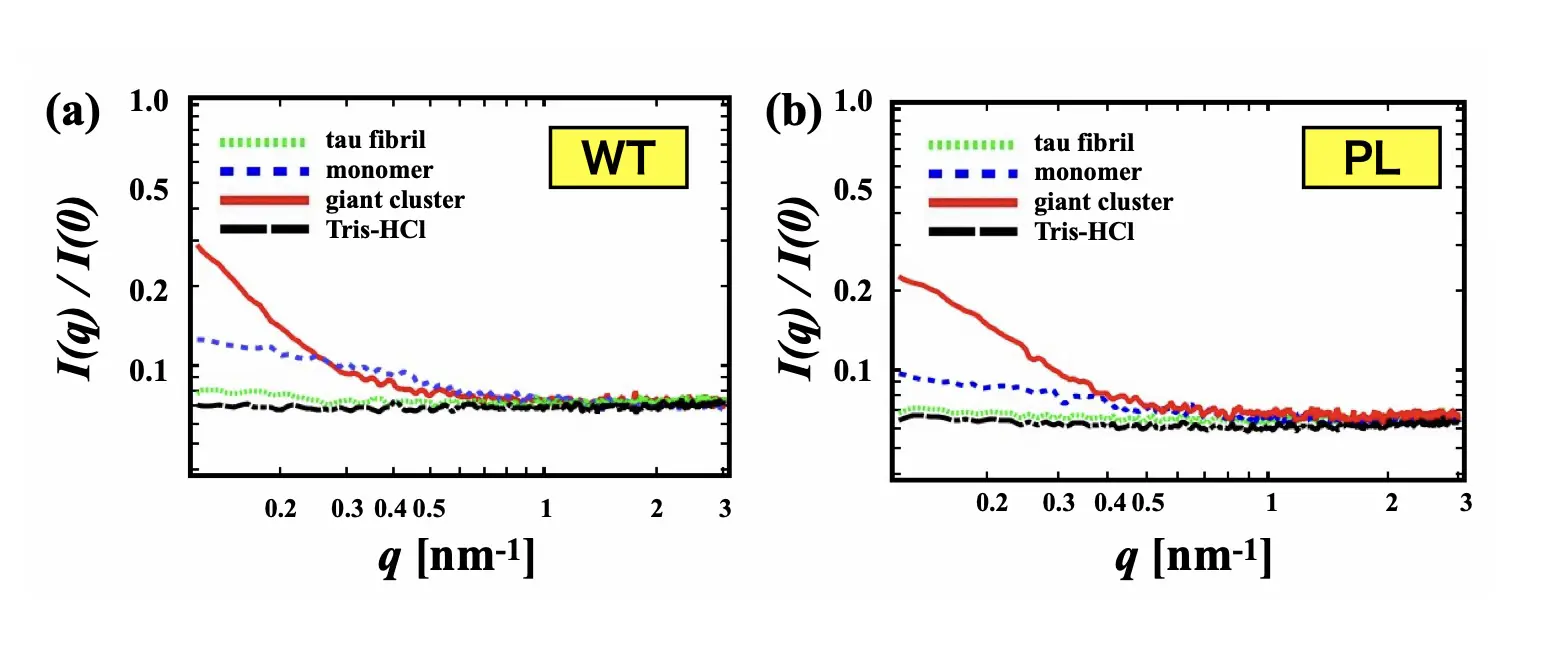
タウタンパク質はヘパリンを添加したのち、震盪すると線維化することが知られています。タウタンパク質にヘパリンを添加した溶液をX線小角散乱(SAXS)(注5)を用いて調べたところ、タウタンパク質が線維とは異なる巨大な「前駆体クラスター」を形成していることが明らかになりました(図2)。このクラスターはアミロイド線維のように硬く固定された構造ではなく、可逆的に形成と解体を繰り返す特性を持っていました。
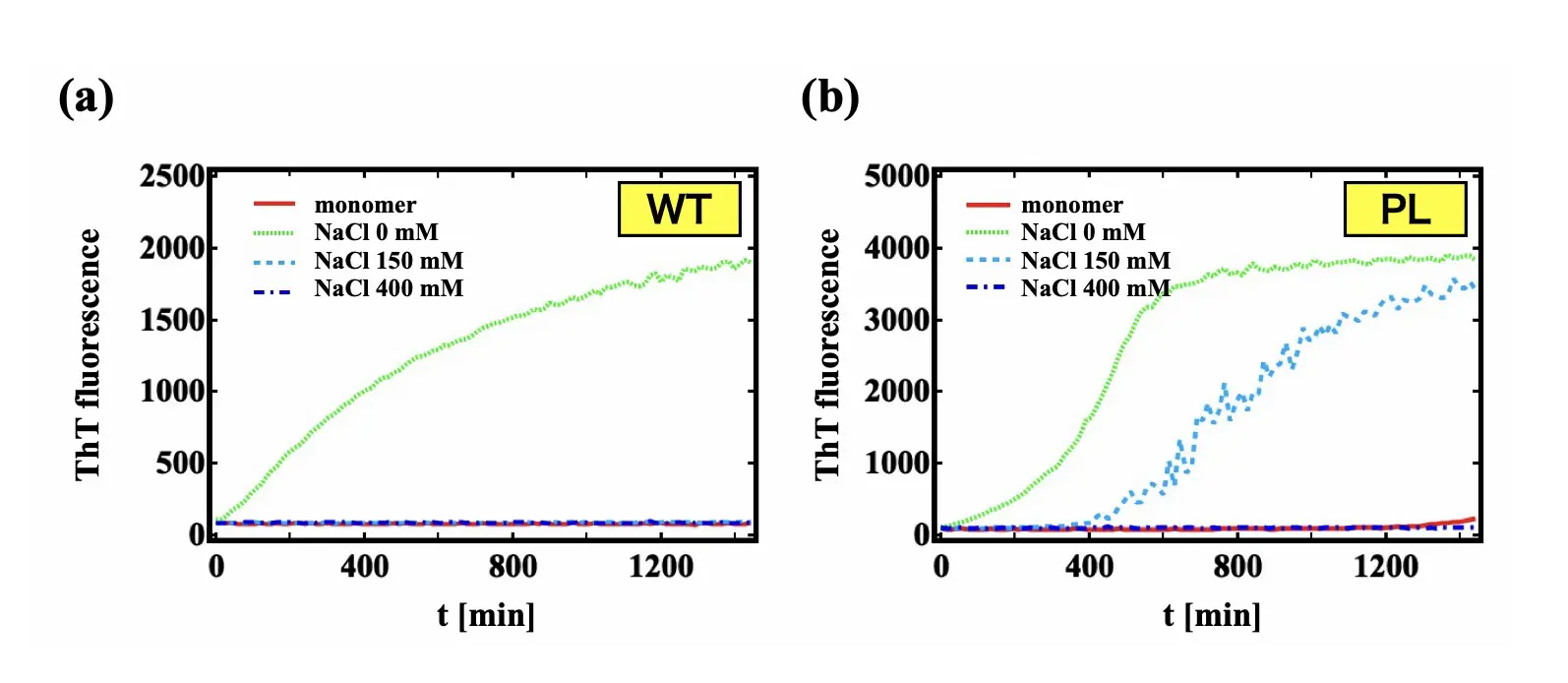
さらに重要なのは、このクラスターを人為的に壊すと線維化が抑制されたという点です。具体的には、溶液に塩化ナトリウム(NaCl)を加えることで、タウと陰性高分子(ヘパリン)との静電的な結合が阻害され、形成されたクラスターが崩壊しました。その結果、タウの線維化は著しく遅れるか、ほとんど進まなくなることが確認されました(図3)。
研究の意義と波及効果
タウタンパク質の線維化過程において「前駆体クラスター」は線維化を促進する中間段階であり、しかも可逆的に操作できる「治療的に狙いやすいポイント」であることが示されました。高分子物理において前駆体が結晶構造を決めるように、神経変性疾患に関わる天然変性タンパク質でも前駆体が病理的な線維化の方向性を左右すると期待されます。
今回の成果は、アルツハイマー病研究において「完成した線維」から「その手前の可逆的な前駆体」へと注目点を大きくシフトさせるものです。これは、タウの凝集を抑制する新しい治療戦略の基盤になる可能性があり、さらにパーキンソン病のαシヌクレインなど、他の神経変性疾患に関わるタンパク質の理解や治療法開発にも広く応用できると期待されます。
【用語解説】
- 1.アルツハイマー病:
- アルツハイマー型認知症のこと。日常生活に支障をきたす記憶およびその他の知的活動能力の消失を示す認知症のうち、アルツハイマー型認知症はその60~80%を占めている。
- 2.タウタンパク質:
- 神経細胞の中で微小管と呼ばれる構造を安定させる役割を持つタンパク質。正常時は細胞の骨組みを支えるが、異常に集まって線維をつくると神経細胞を傷つけ、アルツハイマー病などの原因になると考えられている。
- 3.前駆体クラスター:
- 分子が結晶化(規則正しく秩序化)する前に別の構造体を局所的に形成し、それが結晶化を促進するもの。
- 4.天然変性タンパク質:
- 特定の三次元構造を持たず、柔軟で動的な状態にあるタンパク質の総称。従来のタンパク質は、機能を発揮するために安定した立体構造を形成することが前提とされてきたが、天然変性タンパク質はそのような構造を持たないにもかかわらず、細胞内で重要な機能を果たしている。
- 5.X線小角散乱:
- 試料にX線を当てて散乱された光のうち、小さい角度に散乱されたものを測定する手法。試料の1 nm〜数10 nmの内部構造を測定することができる。
- 6.チオフラビンT蛍光測定:
- チオフラビンTがタンパク質の線維構造に特徴的なクロスベータシートに結合すると、蛍光を発する。蛍光強度がタンパク質の線維化を示していることになる。
