2025年12月22日
広島大学大学院医系科学研究科の松本大亮助教(現 当研究所 主任研究員)、当研究所 宮岡佑一郎再生医療プロジェクトリーダーらのグループは「遺伝子編集の精度を高める新しい仕組みを開発~安全で確実性の高い遺伝子治療や精密さが求められる基礎研究に貢献~」についてJournal of Biomedical Science に発表しました。
遺伝子編集の精度を高める新しい仕組みを開発
~安全で確実性の高い遺伝子治療や精密さが求められる基礎研究に貢献~
【本研究成果のポイント】
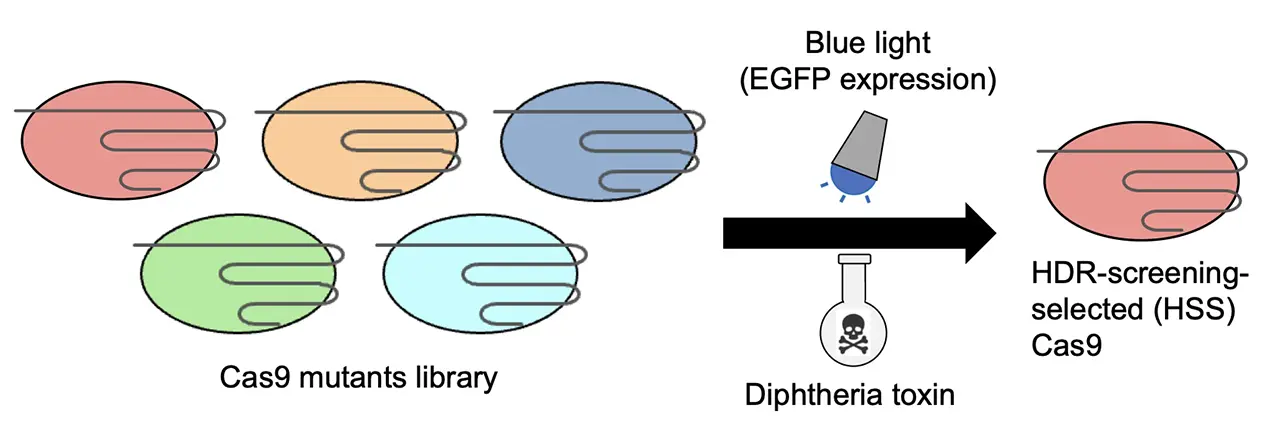
- ヒト細胞内で、遺伝子編集を行う際、オフターゲット作用(不要な場所のDNA切断)が起こらずに、目的の遺伝子修復(HDR)が成功した細胞だけを選別する独自スクリーニングシステムを開発しました。
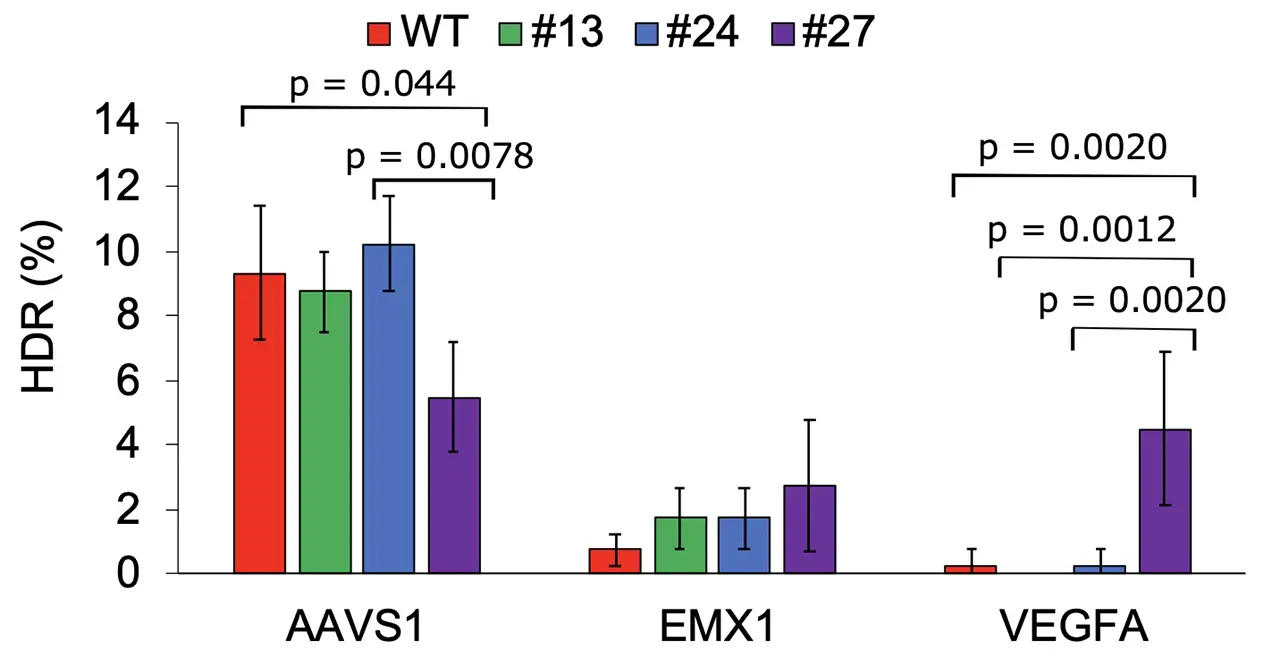
- 本システムを用いて、標的 DNA を改変する新規のゲノム編集技術Cas9変異体「HSS Cas9」を獲得しました。HSS Cas9は野生型Cas9よりも特定の標的配列において高いHDR効率を示します。
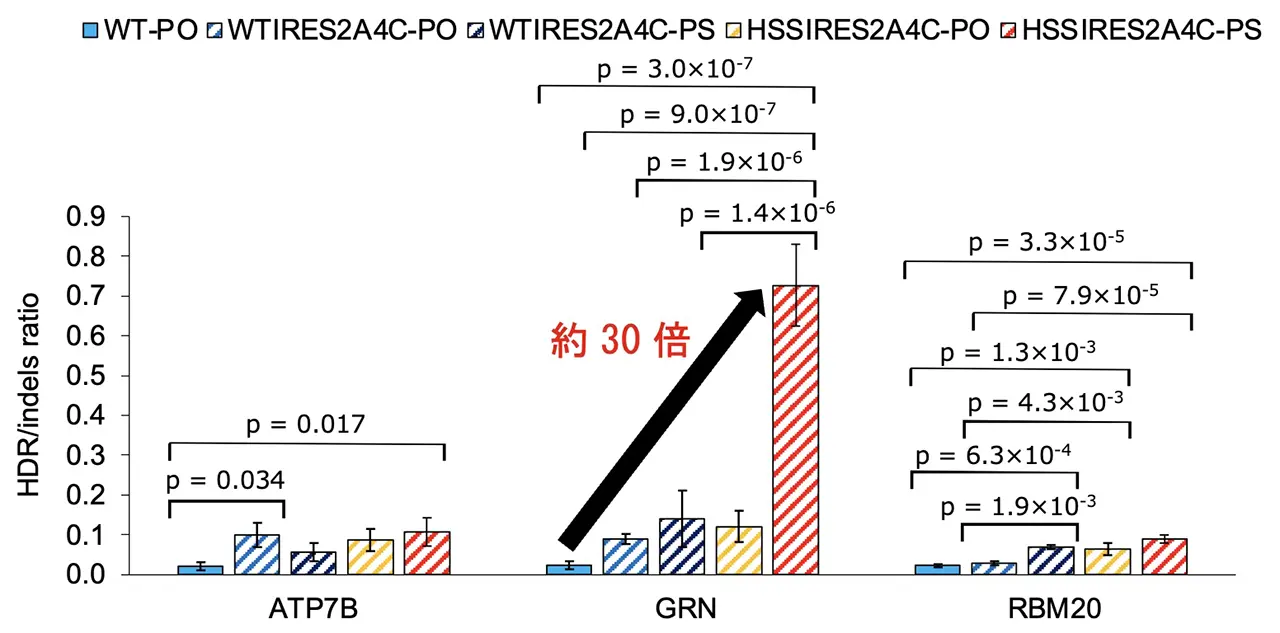
- HSS Cas9とHDRが活発になる細胞周期制御技術(AcrIIA4-Cdt1)を組み合わせることで、不要な変異(インデル)の発生を大幅に抑制し、遺伝子編集の「正確性(HDR/インデル比)」を最大約30倍以上に向上させることに成功しました。
- 遺伝子編集の精度向上によって、安全で確実性の高い遺伝子治療法の開発や、精密な遺伝子改変が求められる基礎研究分野での活用が期待されます。
【概要】
広島大学大学院医系科学研究科の松本大亮助教(現 当研究所主任研究員)、野村渉教授、山口大学大学研究推進機構中高温微生物研究センターの佐藤悠助教、当研究所 宮岡佑一郎再生医療プロジェクトリーダーらのグループはヒト細胞においてHDRが成功するとジフテリア毒素への耐性を獲得する仕組みと緑色蛍光の消光によりオフターゲット作用を検出する仕組みを利用した、独自のスクリーニングシステムを構築しました。このシステムを用いてCas9変異体ライブラリを探索した結果、2つの新規アミノ酸変異(I795V/K918E)を持つ「HSS Cas9」を同定しました。HSS Cas9は、野生型Cas9と比較して、特定の遺伝子標的(EMX1, VEGFAなど)において高いHDR効率を示しました。さらに、HSS Cas9と細胞周期依存的にCas9を活性化させる技術(AcrIIA4-Cdt1)を組み合わせることで、インデルの発生を強く抑制し、遺伝子編集の正確性(HDR/インデル比)を飛躍的に向上させることに成功しました。本成果は、より安全で高精度な遺伝子治療技術の開発に貢献するものです。
本研究成果は、「Journal of Biomedical Science」に令和7年12月3日付でオンライン掲載されました。
発表論文
- <論文タイトル>
- “Screening Strategy to Identify Cas9 Variants with Higher HDR Activity Based on Diphtheria Toxin”
- <著者>
- 松本 大亮1,2,3,*、久保田 小茉利1、佐藤 悠4、加藤-乾 朋子3、濁川 清美1,2、宮岡 佑一郎3、野村 渉1,2,*
- 広島大学薬学部
- 広島大学大学院医系科学研究科
- 東京都医学総合研究所
- 山口大学大学研究推進機構中高温微生物研究センター * 責任者
- <発表雑誌>
- Journal of Biomedical Science
DOI:10.1186/s12929-025-01197-9
URL:https://link.springer.com/article/10.1186/s12929-025-01197-9
【研究助成】
この研究成果は、科研費、JSPS 地域中核・特色ある研究大学強化促進事業(J-PEAKS)JPJS004 20230011、HIRAKU-Global、武田科学振興財団、内藤記念科学振興財団、上原記念生命科学財団、持田記念医学薬学振興財団、鈴木謙三記念医科学応用研究財団の支援を受けて研究を行い、得られたものです。
【背景】
ゲノム編集技術は、遺伝性疾患やがんの治療法として期待されています。ゲノム編集技術では、標的とする遺伝子を切断することが必要となります。これまでにジンクフィンガーヌクレアーゼ(ZFN)やTALEN(例:Platinum TALEN)などが開発されてきており、現在では目的に沿った使い分けが可能な状況となっています。そのなかでもCRISPR-Cas9は標的配列を自在に特異的に標的化できるという点から、主要なゲノム編集ツールとして汎用されています。これらのツールはいずれも標的とする遺伝子配列を切断する機能を持っています。しかし、DNAを切断した後、あらかじめ用意した正しい遺伝子配列(テンプレートDNA)を使って正確に修復する「HDR(相同組換え修復)」の効率が低いことが大きな課題でした。ゲノム編集では、多くの場合に標的配列がエラーを伴いやすい「NHEJ(非相同末端結合)」によって修復されてしまい、意図しない変異(インデル)が生じてしまうためです。精度の高いゲノム編集によってより安全性の高い遺伝子治療が可能となりますが、この実現には、HDR効率を向上させることが不可欠です。しかし、これまでに決定的な解決策は示されていません。
【研究成果の内容】
研究グループはまず、ヒト細胞内でHDRによる修復に成功した細胞だけが生き残り、緑色蛍光タンパク質の消光によってゲノム編集操作における副作用であるオフターゲット作用を検出する、スクリーニングシステムを開発しました(図1)。このシステムを用いて、Cas9のDNA切断に関わるドメインにランダムな変異を導入したライブラリを探索した結果、これまでに報告のなかった2つのアミノ酸変異(I795V/K918E)を持つ変異体「HSS Cas9(HDR-Screening-Selected Cas9)」を発見しました(図2)。このHSS Cas9は、野生型のCas9と比較して、特定の遺伝子標的において高いHDR効率を示しました。
さらに、研究グループはHSS Cas9と、HDRが活発になる細胞周期(S/G2期)でのみCas9を活性化させる既存の技術(AcrIIA4-Cdt1)を組み合わせました。その結果、望まない変異(インデル)の発生を劇的に抑制しつつ、高いHDR効率を維持することに成功。編集の「正確性(HDR/インデル比)」を、標的遺伝子によっては野生型Cas9と比べて最大約30倍以上に向上させることを実証しました(図3)。
【今後の展開】
Cas9によるヒト細胞のゲノム編集が報告されてから10年以上が過ぎ、基本特許の有効期間も折り返しの10年間を迎えています。今回開発されたスクリーニングシステムは、ランダムなCas9変異体の中からヒト細胞内での高精度な修復を起こしやすい変異体を選抜することができます。今後、このスクリーニングシステムに改良を加えながら、より大規模なスクリーニングを実施することで、新たなバージョンのHSS Cas9の獲得に展開していきます。これによって、より安全で確実性の高い遺伝子治療法の開発や、精密な遺伝子改変が求められる基礎研究分野での活用が期待されます。
【参考資料】