HOME > 広報活動 > 刊行物 > Jul. 2014 No.014

Jul. 2014 No.014
特集
研究紹介
開催報告
お知らせ・編集後記
研究紹介
細胞内タンパク質分解装置「プロテアソーム」の動態を解明
~細胞内の不要タンパク質を一生懸命こわしています~
蛋白質代謝研究室 副参事研究員佐伯 泰
研究の背景
プロテアソームは細胞内で不要となったタンパク質をピンポイントで分解する酵素で、細胞内タンパク質の恒常性維持に中心的な役割を果たしています。 プロテアソームがうまく働かず、傷んだり不要となったタンパク質が細胞内でたまってしまったり、逆に必要なタンパク質が誤って分解されてしまったりすると、がんやアルツハイマー病、パーキンソン病、炎症や心筋梗塞などの病気が起こってしまうと考えられています。
プロテアソームの名付け親である田中啓二所長のもと、蛋白質代謝研究室では、プロテアソームがどうやってタンパク質を壊すのか、どんな形をしているのか、どうやって作られるのか、などプロテアソームの基本的な性状を解析してきました。 今回の研究では、プロテアソームの動きを解析し、プロテアソームが生きた細胞のなかで一生懸命働いている様子を捉えることに成功しました。
研究成果の概要
プロテアソームの名前の由来は、タンパク質分解酵素(protease)と巨大粒子(some)です。 プロテアソームがどれ位大きいかというと、タンパク質を作るリボソームや風邪のウイルスより大きい。 さらに、約70個のパーツからできており、一般的な実験手法が通用しない中々やっかいな分子である、そのため、プロテアソームが細胞内にどの程度存在するのか、どのように存在するのかなど、細胞内における動態ははっきりしませんでした。
そこで今回、蛍光タンパク質GFPをプロテアソームのパーツに結合させた酵母細胞を作製し、蛍光のゆらぎを測定する蛍光相関分光法によって、プロテアソームの動態を生きた細胞で解析しました。 その結果、 ①プロテアソームはほぼ完成体であり安定に存在すること、 ②プロテアソームの約半数は細胞内を自由に動き回れること、 ③残りの半数は何らかの細胞小器官や染色体とくっついていること、 ④酵母1細胞あたり約10000分子のプロテアソームが存在すること、 ⑤プロテアソームは細胞質で完成した後に核の中に移動することが明らかになりました。(下図)
図:プロテアソームは細胞の中を駆け巡り、不要となったタンパク質を分解している
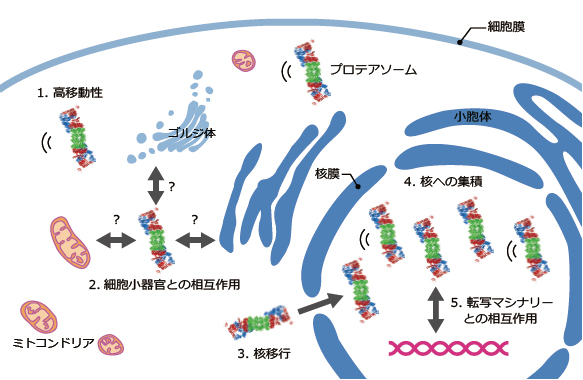
現在、ヒトの細胞でも解析を進めていますが、今後、プロテアソームがどの細胞小器官と相互作用しているか、プロテアソームの動きがどのようにコントロールされているかを解明していく予定です。 今日、プロテアソームの機能を阻害する薬剤は抗がん剤として使われていますが、強い副作用があるため次世代のプロテアソーム阻害剤が待たれております。 私たちも将来、プロテアソームの動きを制御する新しいプロテアソーム調節剤の開発を目指します。
この研究は当研究室と理化学研究所・佐甲細胞情報研究室の白燦基博士が中心となり行われた研究であり、東京大学・千葉大学・愛知学院大学・独マックスプランク研究所との共同研究です。
2014年3月に英国科学雑誌「Nature Communications(ネイチャー・コミュニケーションズ)」に発表されました。
参考文献
Pack CG, Yukii H, Toh-e A, Kudo T, Tsuchiya H, Kaiho A, Sakata E, Murata S, Sako Y, Baumeister W, Tanaka K and Saeki Y. Quantitative live-cell imaging reveals spatio-temporal dynamics and cytoplasmic assembly of the 26S proteasome.
Nature Commun. 2014 Mar 6;5:3396. doi:10.1038/ncomms4396

