HOME > 広報活動 > 刊行物 > April 2015 No.017

April 2015 No.017
特集
研究紹介
開催報告
お知らせ・編集後記
研究紹介
難病"クッシング病"の原因遺伝子と発症機構を解明
~ 細胞増殖因子の過剰作用が引き金に ~
英科学誌「Nature Genetics(ネイチャー・ジェネティクス)」に田中啓二所長・蛋白質代謝研究室の佐伯泰副参事研究員らの研究成果が発表されました。
蛋白質代謝研究室 副参事研究員佐伯 泰
2014 年12月にNature Genetics 誌に発表された私たちの仕事を紹介させていただきます。本研究は東京工業大学大学院生命理工学研究科の駒田雅之教授、Medizinische Klinik und Poliklinik IV研究所(ドイツ)のマーティン・レインケ所長、そして東京都医学総合研究所蛋白質代謝研究室(リーダー:田中啓二所長)の研究グループによるもので、厚生労働省が特定疾患に指定している「クッシング病」が発症する仕組みを世界で初めて解明しました。
1.研究の背景
クッシング病は、脳下垂体腫瘍により副腎皮質で作られるホルモンが増え過ぎるために起きる病気で、手足は細いのに胴体や顔が太るという身体的症状のほか、高血圧や糖尿病、骨粗鬆症などの合併症を引き起こし、死に至ることもある難病です。脳下垂体腫瘍を切除する以外に治療方法はなく、鼻腔や歯茎から内視鏡を挿入する難しい手術となるため、治療薬の開発にむけ、その発症機構の解明が待たれていました。
2.研究成果の概要
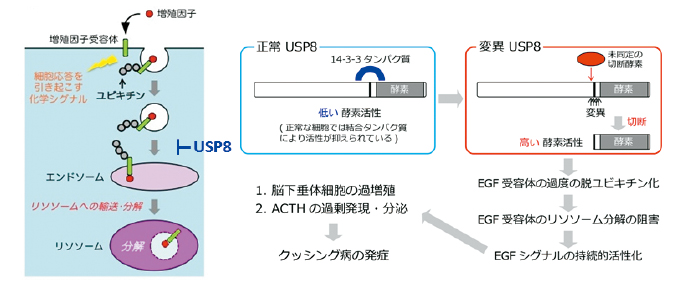
研究グループはクッシング病の患者17人から摘出した脳下垂体腫瘍の遺伝情報を網羅的に解析したところ、35%に当たる6人で、「USP8」遺伝子の体細胞変異を同定しました。USP8は脱ユビキチン化酵素の一つであり、EGF受容体など増殖因子受容体の安定性を制御していることが知られています。EGF受容体は細胞表面で増殖因子と結合することにより活性化し、細胞増殖のための様々なシグナルを発信しますが、この増殖シグナルが入らないと細胞は死んでしまい、逆にシグナルが過剰に入ると異常増殖、つまり“がん化”します。増殖因子受容体は活性化した後、ユビキチン(分解の目印となる小さなタンパク質)で標識され、それがシグナルとなって細胞内小器官リソソームに運ばれ分解されます。USP8はユビキチンを外すことで、EGF受容体のリソソーム分解を阻害すること、つまりEGF受容体を安定化させることが知られていました。
今回見出しましたUSP8の変異は、14-3-3と呼ばれるタンパク質の結合モチーフ(たった6アミノ酸)に集中していました。14-3-3タンパク質はUSP8と結合することでUSP8の脱ユビキチン化活性を抑制するのですが、生化学的な解析を進めましたところ、変異USP8は14-3-3との結合能が低下していること、さらに限定分解により2つのタンパク質断片に切断されていることがわかりました。この短い方の断片はUSP8の酵素活性ドメインそのものであり、これがEGF受容体を過度に脱ユビキチン化することで、EGF受容体が細胞膜へリサイクリングされ、持続的なEGFシグナルの発信が引き起こされることが示唆されました。次いで、マウスの下垂体副腎皮質刺激ホルモン産生細胞株に変異USP8を発現させたところ、確かにEGFシグナルに依存したホルモン分泌量が増加しました。
以上の研究より、USP8の14-3-3結合モチーフの変異が過剰活性化変異となりクッシング病の引き金になる こと、そして、その活性化はUSP8の限定分解によることが示されました(図)。USP8の切断酵素はまだ見つかっておりませんが、USP8およびその切断酵素は、クッシング病治療薬の有効な分子標的ですので、今後、さらに詳細な解析を進めていきたいと思います。
USP8遺伝子の変異によるクッシング病の発症の分子機構
Reincke, M., Sbiera, S., Hayakawa, A., Theodoropoulou,M., Osswald, A., Beuschlein, F., eitinger, T., Mizuno-Yamasaki, E., Kawaguchi, K., Saeki, Y., Tanaka, K., Wieland,T., Graf, E., Saeger, W., Ronchi, CL., Allolio, B., Buchfelder,M., Strom, TM., Fassnacht, M., and Komada, M. (2015)Mutations in deubiquitinase USP8 cause Cushing's disease. Nature Genetics 47, 31-38. doi: 10.1038/ng.3166

