HOME > 広報活動 > 刊行物 > July 2016 No.022

Jul. 2016 No.022
特集
研究紹介
開催報告
お知らせ・編集後記
研究紹介
プロフィリン1遺伝子の異常によって筋萎縮性側索硬化症(ALS)が発症する仕組みを解明
英国科学誌「Human Molecular Genetics(ヒューマン· モレキュラー· ジェネティクス)」に認知症プロジェクトの田中良法研究員、野中隆副参事研究員、鈴木元治郎主席研究員、亀谷富由樹主席研究員、長谷川成人参事研究員の研究成果が発表されました。
認知症プロジェクト 研究員田中 良法
1.研究の背景
筋萎縮性側索硬化症(ALS)は、運動を制御する神経細胞が弱り、筋肉に情報が伝わらなくなることで、重篤な筋肉の萎縮を引き起こす疾患です。ALSでは運動を制御する神経細胞に「TDP-43」という本来細胞の核に存在するタンパク質が、病的な形をとって細胞質に蓄積しています。この病的なTDP-43はプリオン病の原因タンパク質である異常プリオンのように、正常なTDP-43を病的なTDP-43に変換することで蓄積していくことが知られています。TDP-43の核内における働きは細胞の生存にとって不可欠であるため、細胞質における病的なTDP-43の蓄積はALSの発症に強く関係していると考えられ ています。近年、遺伝性ALSの原因としてプロフィリン1(PFN1)遺伝子の異常が同定されました。本研究では、PFN1遺伝子の異常によるALS発症機序を調べるために、PFN1遺伝子の異常と病的なTDP-43蓄積の関係に着目しました。
2.研究成果の概要
異常型PFN1を神経系培養細胞に発現させると、細胞質内に不溶性の凝集体を形成し、TDP-43を捕捉していることがわかりました。また、異常型PFN1とTDP-43を細胞に同時に発現させると、細胞質内に病的なTDP-43が蓄積することがわかりました。さらに、異常型PFN1を発現させた細胞の不溶性画分を、TDP-43を発現させた細胞に導入した場合にも、病的なTDP-43が蓄積することがわかりました。以上のことから、PFN1遺伝子の異常によってPFN1凝集体が形成され、それがTDP-43を捕捉することにより病的なTDP-43が形成されやすくなること、さらには病的なTDP-43がその異常プリオン様性質により正常TDP-43を病的なTDP-43に変換して、TDP-43の蓄積を促進すると考えられます(図参照)。
図. 変異型PFN1がTDP-43の細胞質内蓄積を誘起する仕組み
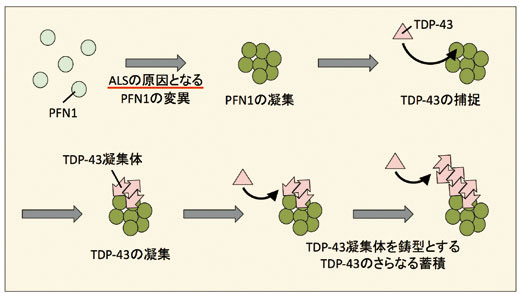
PFN1はALSの原因となる変異によって凝集体を形成する。PFN1凝集体は正常なTDP-43を捕捉し、病的なTDP-43が形成されやすくなる。病的なTDP-43は正常なTDP-43を病的なTDP-43に変換し、TDP-43の蓄積が進行する。
3.発見の意義
本研究は病的なTDP-43が蓄積する分子機構の一端を明らかにしたものです。この研究の発展により、PFN1遺伝子の異常によって発症するALSだけではなく、病的なTDP- 43を蓄積する疾患の治療法や創薬の開発につながる可能性が期待されます。
参考文献
Tanaka Y, Nonaka T, Suzuki G, Kametani F, Hasegawa M. Gain-of-function profilin 1 mutations linked to familial amyotrophic lateral sclerosis cause seeddependent intracellular TDP-43 aggregation. Hum Mol Genet. 2016 Apr 1;25(7):1420-33. doi: 10.1093/ hmg/ddw024.

