HOME > 広報活動 > 刊行物 > July 2016 No.022

Jul. 2016 No.022
特集
研究紹介
開催報告
お知らせ・編集後記
研究紹介
ALS患者脳中に異常蓄積したTDP-43を質量分析器を使いタンパク質化学的に解明
英国科学雑誌「Scientific Reports(サイエンティフィック· レポート)」に認知症プロジェクト 亀谷 富由樹 主席研究員、長谷川 成人 参事研究員らの論文が発表されました。
認知症プロジェクト主席研究員亀谷 富由樹
認知症プロジェクトリーダー長谷川 成人
1.研究の背景
筋萎縮性側索硬化症(ALS)患者の脳脊髄には核タンパク質の一種であるTDP-43が線維化して蓄積し、病気の発症や進行と密接に関係することが知られています。私たち は、これまで抗体を用いた研究で、患者脳には異常リン酸化や断片化が生じたTDP-43が蓄積していることを報告してきました。しかしながら、抗体を用いた解析だけでは、そ の異常な部位や切断箇所を明らかにすることが困難であり、蓄積機序の解明のためには、より詳細な解析が必要でした。そこで、患者脳に蓄積したTDP-43のリン酸化部位を含む翻訳後修飾※1、断片化する際の切断部位等を高速液体クロマトグラフィー質量分析器を用いて解析し、タンパク質化学的に初めて明らかにしました。
2.研究成果の概要
ALS患者脳から蓄積する異常TDP-43を代表的なタンパク質分解酵素であるトリプシンとキモトリプシンで消化し、生じたペプチド断片を回収しました。これらのペプチドの 質量分析によって、以下のことが判明しました。
(1)今回同定できたリン酸化部位は、以前私たちが免疫化学的手法で同定したリン酸化部位や、試験管内実験においてカゼインキナーゼ1でリン酸化した際のリン酸化部 位と一致しました。リン酸化以外の翻訳後修飾※1として、複数のアスパラギンおよびグルタミン残基で脱アミド化が生じていること、複数のメチオニン残基が酸化されているこ とを見出しました。さらに、一部のリジン残基にユビキチン化やアセチル化が生じていることを見出しました。
(2)以前より培養細胞を用いた解析において、タンパク質分解酵素の一種であるカスパーゼがTDP-43の断片化に関与しているという報告がなされていましたが、今回、患 者脳に蓄積したTDP-43において見出された複数の切断部位(図)はカスパーゼ切断部位ではなく、TDP-43蓄積にカスパーゼが関与する可能性は低いことが示唆されました。
図.ALS患者脳に蓄積したTDP-43に見出された断片の切断部位の模式図
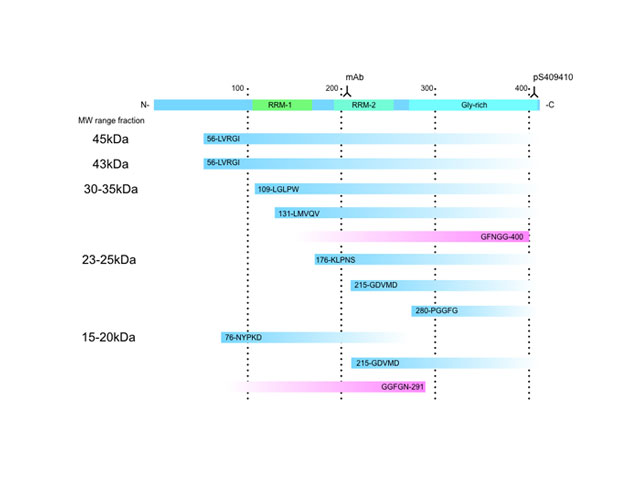
図. 左側に電気泳動および免疫科学的手法で検出された蓄積したTDP-43に由来する成分の分子量を示した。その成分から、水色で示されたところから始まる(N末端側)TDP-43断片およびピンク色の部分で終わる(C末端側)TDP-43断片を検出した。
3.発見の意義
ALS患者脳内のTDP-43に起こった翻訳後修飾※1や断片化を初めて明らかにできました。このことによってTDP-43の 蓄積機序の解明、ALSの予防・治療法の開発が進むと考えられます。
参考文献
Mass spectrometric analysis of accumulated TDP-43 in amyotrophic lateral sclerosis brains
Kametani F, Obi T, Shishido T, Akatsu H, Murayama S, Saito Y, Yoshida M, Hasegawa M.
Scientific Reports 2016:6:23281. doi:10.1038 /srep23281
用語説明 ※1
タンパク質はDNAの遺伝子情報にもとづき、アミノ酸がN末端から順番に結合して生成されます。これをタンパク質の翻訳と呼びます。多くのタンパク質はこれだけでは機能を持たず、リン酸化や糖鎖付加といった化学反応をうけて機能を持ちます。これを翻訳後修飾と呼びます。本稿で登場する脱アミド化,ユビキチン化、アセチル化も翻訳後修飾の一種です。

