HOME > 広報活動 > 刊行物 > Jan 2018 No.028

Jan. 2018 No.028
特集
研究紹介
開催報告
受賞
編集後記
研究紹介
ユビキチン化基質がプロテアソームに運ばれる仕組み
~疾患の発症機構解明につながることを期待~
米国科学誌 「Molecular Cell」 に蛋白質代謝研究室の土屋光研究員らが 「ユビキチン化基質がプロテアソームに運ばれる仕組み」 について発表しました。
蛋白質代謝研究室 研究員土屋 光
1.研究の背景
ユビキチンは酵母からヒトまで保存された小さなタンパク質です。ユビキチンが目印として付加された不要なタンパク質や異常タンパク質はプロテアソーム (*1)により認識され速やかに分解・除去されます。これまでユビキチン化されたタンパク質はプロテアソームに直接認識されて分解されると考えられてきました。一方、補完的な経路として、Rad23やDsk2などのシャトル分子やCdc48/p97(*2)がユビキチン化タンパク質をプロテアソームに運搬する間接的な経路も知られていますが、プロテアソーム分解にどの程度関与しているのかは不明でした。
2.研究成果の概要
私たちはモデル生物である酵母を用いてプロテアソームが認識するユビキチン鎖の定量解析をおこないました。シャトル分子Rad23およびDsk2の二重欠損細胞を解析したところ、驚くべきことにプロテアソームに結合するユビキチン鎖の量が10%以下まで減少しました。一方、Cdc48の不活化変異体においてはユビキチン化基質がプロテアソーム上に大量に蓄積していることが明らかとなりました。これらのことから、Cdc48/p97とRad23/Dsk2を介した間接的な経路がプロテアソーム依存的タンパク質分解の主要経路であることが初めて分かりました(図)。
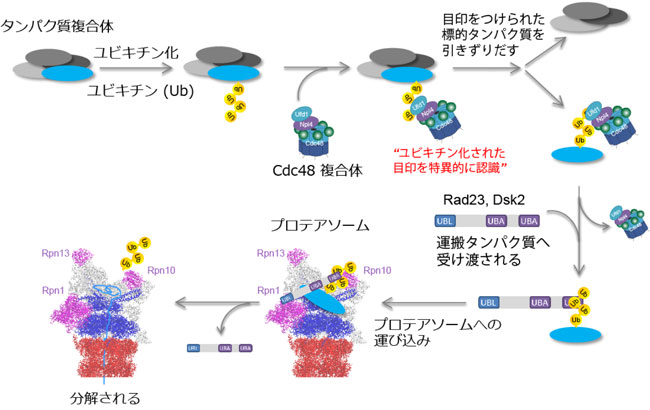
3.発見の意義
ユビキチン・プロテアソーム系の破たんはガンや神経変性疾患と密接に関わっており、Cdc48/p97 およびRad23/Dsk2は新たな創薬のターゲットになることが期待されています。
用語説明
*プロテアソーム:
細胞内の不要なタンパク質を分解する巨大な酵素複合体。ユビキチンが付加されたタンパク質を選択的に分解することにより様々な生命現象を制御しています。
*2 Cdc48/p97:
Cdc48/p97はAAA+ATPaseタイプのユビキチン選択的シャペロン分子です。小胞体関連タンパク質分解経路などのタンパク質品質管理に関与することが知られています。
参考文献
Tsuchiya, H., Ohtake, F., Arai, N., Kaiho, A., Yasuda, S., Tanaka, K., and Saeki, Y.
In vivo ubiquitin linkage-type analysis reveals that the Cdc48-Rad23/Dsk2 axis contributes to K48-linked chain specificity of the proteasome.
Mol. Cell 66, 488-502 (2017) doi:10.1016/j.molcel.2017.04.024

