HOME > 広報活動 > 刊行物 > July 2013 No.010

July 2013 No.010
特集
研究紹介
開催報告
編集後記
特集
ストップ・ザ・糖尿病合併症
東京都医学総合研究所 運動・感覚システム研究分野三五 一憲

我が国の2型糖尿病*1患者数は急増しており、しかも糖尿病が強く疑われる人の半数近くが医療機関を受診していないと推定されます。糖尿病はその予備軍の段階から既に動脈硬化が進行しており、心筋梗塞や脳梗塞の発症リスクが高いことがわかっています。また糖尿病特有の慢性合併症(神経障害、網膜症、腎症)が進行し、足切断、失明、人工透析導入などの深刻な事態を招いてしまいます。本稿では私たちの研究も含め、糖尿病およびその合併症に関する最近のトピックスを紹介致します。
ヘモグロビンA1cの国際標準化と、糖尿病の管理目標に関する「熊本宣言」
赤血球中のタンパク質ヘモグロビンに、ブドウ糖(グルコース)が結合したものがグリコヘモグロビンです。このグリコヘモグロビンには何種類かあり、糖尿病と密接な関係を有するものが、ヘモグロビンA1c(HbA1c)です。血糖値は測定時点の状態しか反映していませんが、HbA1c値をみれば過去1-2ヶ月間の平均血糖値を推測することができます。HbA1c 値に関しては、欧米各国で使用されているNational Glycohemoglobin Standardization Program(NGSP)値と、我が国で独自に使用されてきたJapan Diabetes Society(JDS)値との間に乖離があることがわかり、国際標準化が進められてきました。平成22年10月に確定した正式な換算式(NGSP 値(%)=1.02×JDS値(%)+0.25%)に基づくNGSP 値は、従来のJDS値で表記されたHbA1cにおよそ0.4 %を加えた値となります。平成25年4月1日以降、特定健診・保健指導をはじめとするすべての日常臨床において、NGSP値で表記されたHbA1cを用いることになりました。日本糖尿病学会は熊本で開催された第56回年次学術集会において、合併症予防のため糖尿病患者の血糖管理目標値をHbA1c 7%未満とする「熊本宣言2013-あなたとあなたの大切な人のために Keep your A1c below 7%-」を発表しました。
新たな糖尿病治療薬の開発と臨床応用
食事療法と運動療法で血糖管理が困難な場合は、種々の飲み薬やインスリン注射が必要となります。 しかしながら、従来の薬物療法はその副作用である「低血糖」を起こすこともあり、諸刃の剣であると言えます。近年、食物の摂取に伴い小腸から分泌されるインクレチン(glucagon-like-peptide (GLP)-1やglucose-dependent insulinotropic polypeptide (GIP))の血糖降下作用が注目され、インクレチンの分解を抑制し作用を持続させるdipeptidyl peptidase (DPP)-4阻害薬(飲み薬)と、分解されにくい修飾を加えたGLP-1そのものを注射するGLP-1受容体作動薬が開発され、臨床で用いられるようになりました。インクレチンは血糖値に依存してインスリン分泌を促進するので、これらのインクレチン関連薬は比較的低血糖を起こしにくく、また食欲を抑え体重を増加させない、胃からの食物排出を遅らせ食後高血糖を抑制する、といった「膵外作用」も注目されています。培養細胞を用いた私たちの研究では、GLP-1受容体作動薬が末梢神経系に作用して神経の中心をなす軸索の再生、神経を包む髄鞘の形成を促進するという効果がみられ、糖尿病神経障害をはじめとする末梢神経障害の改善に有用である可能性が示唆されました。本研究成果は、平成25年5月の日本糖尿病学会、日本神経学会シンポジウムにて報告しました。
さらに新たな治療薬として、腎尿細管でのグルコース再吸収を阻害することによって血糖値の上昇を抑えるSGLT2(sodium-glucose co-transporter-2)阻害薬が、来年にも発売されることになりそうです。多種多様な治療薬が処方可能になることは患者さんには朗報ですが、患者さんの病態やライフスタイルを勘案し最も適した薬剤を選択することが医療サイドに求められることになり、糖尿病専門医の育成が喫緊の課題といえます。
糖尿病合併症の発症機構解明と治療薬開発への展望
血糖管理に有用な薬剤の臨床応用が進められる一方で、慢性合併症が進行するメカニズムは現在も充分に解明されておらず、成因に基づいた治療薬の開発は遅れています。網膜症や腎症の病態には毛細血管をはじめとした細小血管病変の関与が大きいのに対して、神経障害では神経細胞やシュワン細胞*2における代謝異常も重要な発症因子とみなされています。なかでもアルドース還元酵素aldose reductase (AR)の活性化に伴うポリオール代謝の亢進(図1)は糖尿病の初期段階からみられ、他の代謝異常や血流障害の起点となることが示唆されています。末梢神経ではシュワン細胞にARが強く発現しており、シュワン細胞におけるポリオール代謝の亢進が糖尿病神経障害の発症に深く関与するものと考えられています。私たちの研究でも、正常マウスから樹立したシュワン細胞株を高グルコース濃度で維持することにより、ARのタンパク発現が上昇し細胞内ポリオール量の著増がみられました。さらに香港大学・Chung教授、弘前大学・八木橋教授、東京慈恵会医科大学・宇都宮教授との共同研究により、AR遺伝子欠損マウスからシュワン細胞株を樹立することができました。この細胞株は、ARの神経系における生理機能や糖尿病神経障害の病態への関与を詳らかにする上で極めて有用と考えられ、現在その解析を進めています。研究成果の一部は、平成25年9月に旭川で開催される日本糖尿病合併症学会シンポジウムで報告する予定です。
我が国で臨床応用されているAR阻害薬(エパルレスタット)は、ポリオール経路の抑制により幅広い代謝異常を是正すると考えられています。またドイツでは、活性酸素の産生を抑制する抗酸化薬として、α-リポ酸が臨床応用されています。しかしながら、血糖管理状況が不良な患者さんや合併症がかなり進行してしまった患者さんには、これらの薬剤を処方しても効果が得られにくいことが示唆されています。厳格な血糖管理を続けなくても合併症の進行を防ぐことができる薬剤、すなわち糖尿病患者さんが切望する「究極の合併症治療薬」の開発には、まだまだ時間がかかりそうです。
図1
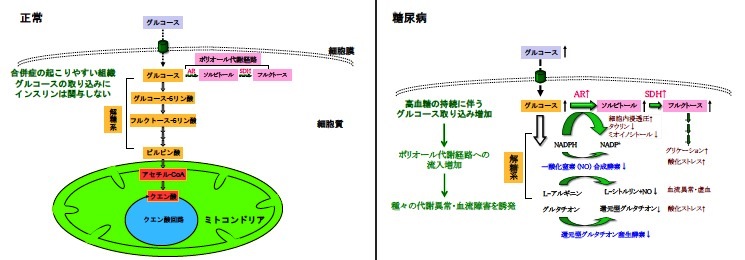
合併症の起こりやすい組織では、グルコースの取り込みにインスリンは関与せず、血糖値に依存すると考えられている。正常(左)では、細胞内に取り込まれたグルコースの多くが解糖系からクエン酸回路に入り処理される。糖尿病(右)では、グルコース量の過剰によって解糖系が飽和状態となり、ポリオール代謝経路への流入が3-4倍に増加する。すなわち、アルドース還元酵素 (Aldose reductase (AR))の活性上昇によってグルコースはソルビトールへと変換され、図に示すような種々の代謝異常・血流障害を引き起こす。(「糖尿病性神経障害 基礎から臨床のすべて」中山書店, 61頁より改変引用)
おわりに
私は医学部を卒業後、糖尿病内科の研修医として診療に携わり、合併症の怖さを目の辺りにしました。現在は神経障害の研究に従事するとともに、医学部や栄養学科の非常勤講師として、病態代謝学・臨床栄養学の講義を担当しています。糖尿病への関心を高めてもらうことで、一人でも多くの学生さんが糖尿病専門医や糖尿病療養指導士を目指して頂ければ有り難いですし、ホームページや出版物を活用して普及広報活動にも力を注いでいくつもりです。本稿をお読みになった皆様が糖尿病を身近な問題と捉え、「自分の健康は自分で守る」という意識を強く持って頂ければ幸いです。あなたとあなたの大切な人のために、ストップ・ザ・糖尿病合併症!
【用語説明】
*1 2型糖尿病:
糖尿病患者の9割以上を占め、遺伝因子に過食、運動不足、ストレス等の生活習慣が加わって発症する。これに対し1型糖尿病は、自己免疫などにより膵ランゲルハンス島β細胞の破壊・脱落が生じ、インスリンが体内で供給できなくなってしまう疾患で、毎日インスリン注射を必要とする。
*2 シュワン細胞:
末梢神経系のグリア細胞。神経細胞の生存と機能維持にかかわる多数の栄養因子、保護因子を産生するとともに、神経軸索を取り巻き髄鞘の形成に与る。我々は、正常ラットから樹立したシュワン細胞株を神経細胞と共培養することにより、生体内とほぼ同じ構造の髄鞘[図2]を作ることに成功した。
図2
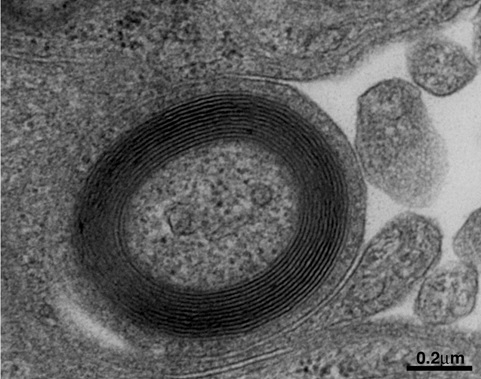
シュワン細胞株と神経細胞との共培養により形成された髄鞘の電子顕微鏡像。(Sango et al., Exp Diabetes Res 2011)

