HOME > 広報活動 > 刊行物 > October 2013 No.011

October 2013 No.011
特集
研究紹介
開催報告
編集後記
研究紹介
アレルギーを起こす新しい脂質代謝経路を解明
米国科学雑誌「Nature Immunology(ネイチャー・イムノロジー)」に脂質代謝プロジェクトの村上誠参事研究員、武富芳隆主任研究員らの研究成果が発表されました。
脂質代謝プロジェクト 主任研究員武富 芳隆
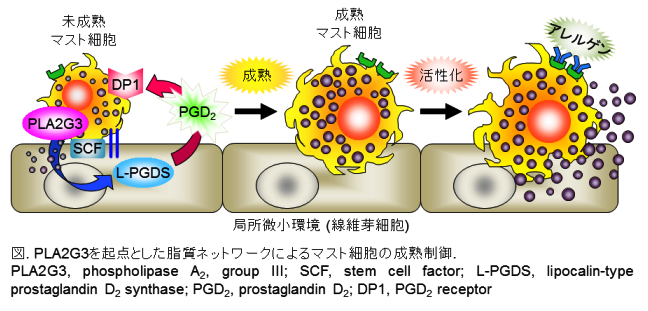
アレルギーの中心細胞であるマスト細胞は骨髄を起源とし、前駆細胞の状態で血中から組織に移行・定着した後、局所微小環境の影響を受けて組織に固有の亜群へと最終成熟します。 成熟したマスト細胞はIgE-アレルゲンなどの刺激により活性化し、アナフィラキシーなどのアレルギー応答を誘起します。 マスト細胞の組織への定着や増殖には線維芽細胞が産生するサイトカインSCF必須であることが知られています。 しかし成熟にはSCF単独では不十分で、マスト細胞と線維芽細胞の相互作用によるプラスαのメカニズムの存在が想定されてきましたが、その責任分子の同定には至っていませんでした。
今回、私たちはそのプラスαの責任分子はマスト細胞との相互作用依存的に線維芽細胞が産生する脂質「プロスタグランジンD2(PGD2)」であり、それを動かすのは脂質パスウェイの初発酵素PLA2G3(アナフィラキシー誘起物質として知られるハチ毒ホスホリパーゼA2(sPLA2)の唯一の哺乳動物ホモログ)であることを発見しました。 すなわち、PLA2G3は未成熟なマスト細胞からSCFの刺激により細胞外に分泌され、隣接する線維芽細胞のPGD2産生酵素L-PGDS(下流酵素)と連関してPGD2を産生し、この産生されたPGD2はマスト細胞に発現誘導されるPGD2受容体DP1(脂質受容体)を活性化することでマスト細胞成熟は促進します(図)。 このPLA2G3を起点とした脂質ネットワークを遮断すると、マスト細胞の成熟は不全となり、アナフィラキシー低応答性を生じます。 本成果は、①マスト細胞の成熟を制御する未知のブラックボックスの解明、②脂質メディエーターPGD2の新たな生理作用の発見、③長い間漠然としていたsPLA2の作用機序ならびに存在意義の確立、④ハチ毒sPLA2がアレルギー誘起物質として作用することの位置付けの解明、など多くの新知見を含み、免疫および脂質の双方の研究領域に貢献するものとして高く評価されました(Nature Immunologyの表紙とハイライトに掲載)。
「マスト細胞の成熟を制御する脂質メディエーター経路」を標的とした創薬は、新しいアレルギー治療予防薬の開発に結びつき得ます。 特に、PLA2G3はゲノム上に類縁の分子が存在せず、また特異的阻害剤が存在しないことから、新規抗アレルギー薬の創薬標的として有望です。
Taketomi Y, Ueno N, Kojima T, Sato H, Murase R, Yamamoto K, Tanaka S, Sakanaka M, Nakamura M, Nishito Y, Kawana M, Kambe N, Ikeda K, Taguchi R, Nakamizo S, Kabashima K, Gelb MH, Arita M, Yokomizo T, Nakamura M, Watanabe K, Hirai H, Nakamura M, Okayama Y, Ra C, Aritake K, Urade Y, Morimoto K, Sugimoto Y, Shimizu T, Narumiya S, Hara S, Murakami M.
Mast cell maturation is driven via a novel group III phospholipase A2-prostaglandin D2-DP1 receptor paracrine axis Nat Immunol 14, 544-563 (2013). doi: 10.1038/ni.2586