HOME > 広報活動 > 刊行物 > Jul. 2015 No.018

Jul. 2015 No.018
特集
研究紹介
開催報告
編集後記
研究紹介
ユビキチン化基質の効率的な同定法の開発
米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」にユビキチンプロジェクトの吉田雪子主席研究員、蛋白質代謝研究室の佐伯泰副参事研究員・田中啓二所長らの研究成果が掲載されました。
ユビキチンプロジェクト 主席研究員吉田 雪子
ユビキチンは、パン酵母から植物及びヒトに至るまで保存された76個のアミノ酸からなる小さなたんぱく質です。ユビキチンはさまざまなたんぱく質のリジン残基に共有結合(アミド結合)し、多くの場合ユビキチンにさらにユビキチンが連なる「ユビキチン鎖」が形成されます。ユビキチン鎖は、細胞内で役割を終えた不要なたんぱく質や異常たんぱく質を速やかに消去するための「たんぱく質分解の目印」となります。また、たんぱく質分解の目印となるばかりではなく、細胞内の情報伝達系・損傷DNAの修復や細胞表層にある膜たんぱく質の細胞内への取り込みの信号として働くなど、多様な生命現象の制御 に関わることも分かってきています。「たんぱく質のユビキチン化」に異常が生じると、神経変性疾患やがんなどの原因となることが知られています。
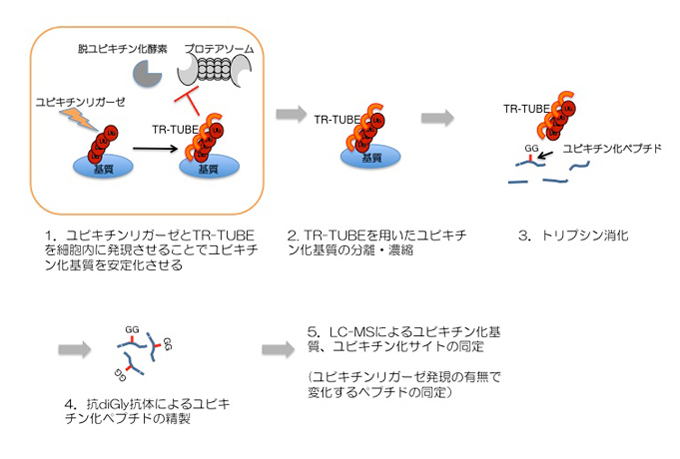
どのたんぱく質にどのタイミングでユビキチン鎖をつけるのか、その「基質の選択性」を決めているのは「ユビキチンリガーゼ(連結酵素)」です。ユビキチンリガーゼはヒトではおよそ600種類ありますが、その基質が明らかとなっているものはごくわずかです。ユビキチンリガーゼの基質を網羅的かつ高感度に探索できる技術の開発は、広範な生命現象の制御に関わるユビキチン化を理解する上でも重要であると考えられます。これまで、さまざまな方法が試されてきましたが、決め手となる方法はありませんでした。今回、新たに開発したユビキチン鎖結合プローブTR-TUBEを細胞に発現させることで、これまで機能のわかっていなかったユビキチンリガーゼの標的分子を容易に見つけ出すことができるようになりました(図)。この同定法を多くの研究者に利用してもらうことにより、新たな生命現象の理解、さらには、さまざまな疾患の発症機構の解明につながることが期待されます。
図
参考文献
- Yoshida Y, Saeki Y, Murakami A, Kawawaki J, Tsuchiya H, Yoshihara H, Shindo M, Tanaka K. A comprehensive
method for detecting ubiquitinated substrates using TR-TUBE. Proc Natl Acad Sci USA, 2015, 112, 4630-4635.
doi:10.1073/pnase.1422313112

