Jul. 2020 No.038
特集
Topics
開催報告
新型コロナに科学で立ち向かう都医学研
編集後記
特集
新プロジェクトリーダー紹介
蛋白質代謝プロジェクトリーダー佐伯 泰

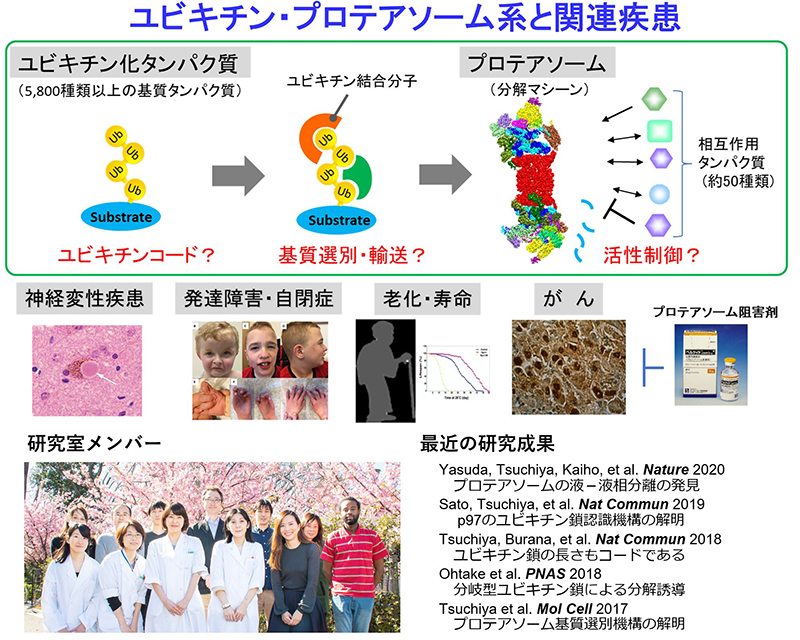
タンパク質分解の仕組みを理解し制御する
2020年度4月より蛋白質代謝プロジェクトリーダーを拝命しました。タンパク質の新陳代謝(リサイクル)は私たちの身体を維持するために必須であり、ちょっとした機能の綻びが様々な病気を引き起こします。本プロジェクトでは、タンパク質分解に中心的な役割を果たす “ユビキチン・プロテアソーム系” について、その分子機構の詳細と各種疾患・老化との関連性を解明し、さらに創薬応用を見据えた制御剤開発を進めます。
私たちの身体の37兆個の細胞の中ではタンパク質が作られては壊されて常に入れ替わっています。細胞の恒常性を保ち、個体の健康を維持するためには、不要なタンパク質を迅速、適切に分解する必要があります。つまり分解ファーストです。タンパク質代謝が適切に行われないと、細胞の中はいわゆる「3密」の状態になり、細胞の恒常性が失われ、細胞死や細胞がん化が誘導されます。
細胞内のタンパク質分解は、主にユビキチン・プロテアソーム系とオートファジー・リソソーム系が担っており、両分解系ともこの数十年で急速に研究が拡大・発展してきました。特に日本人研究者の寄与は大きく、これは、近代オートファジー研究の祖としてノーベル生理学・医学賞を受賞した大隅良典博士(東京工業大学栄誉教授)、そしてプロテアソームの命名者である田中啓二博士(都医学研理事長)の長年のご尽力によるものです。私は、田中啓二先生の下、プロテアソームの最後の構成部品の決定や、プロテアソーム制御粒子の形成メカニズム解明に携わってきました。後者は約10年前にCell誌に掲載され、この論文が私の実質的な世界デビューとなりました。
また、岩井一宏先生(京都大学)が領域代表を務められた新学術領域研究ユビキチンネオバイオロジーに参画し、質量分析を駆使したユビキチン研究を進めてきました。ユビキチンは標的となるタンパク質に共有結合することで、プロテアソームによる分解の目印となりますが、最近では、シグナル伝達や膜タンパク質のエンドサイトーシス、オートファジー誘導などの分解以外の機能をもつことがわかってきました。ユビキチンは数珠状に繋がり鎖として機能しますが、異なる繋がり方のユビキチン鎖は異なる機能をもつことが分かってきており、ユビキチンコードと呼ばれるに至っております。私たちは、プロテアソーム依存的なタンパク質分解経路においてAAA 型ATPase のp97 やシャトル分子のRAD23 がプロテアソーム基質を選別するユビキチンデコーダ―(情報解読分子)であることを見出しました。これは土屋光主任研究員が中心となって行った研究ですが、最近、p97 の補助因子NPL4 によるユビキチン鎖認識の構造解析についても報告しております。また、大竹史明研究員(現・星薬科大学准教授)が中心となり、新しいユビキチンコードである分岐型ユビキチン鎖などを発見し報告してきました。
最近、Nature誌にプロテアソームによるタンパク質分解の新しいモードを報告しました。細胞の中は非常に込み合った環境ですので、プロテアソームがどうやって不要なタンパク質を見つけ出すのか常々不思議に思っておりましたが、安田さや香研究員による定量イメージング解析により、ストレス下ではユビキチン化タンパク質とプロテアソームが液 - 液相分離して分解のための液滴を形成することを発見しました。この相分離はユビキチンデコーダーRAD23に依存しており、生じた液滴にはp97やユビキチンリガーゼUBE3Aなど様々な分子が集積し、ストレスにより生じたリボソームのオーファンタンパク質を迅速に分 解します。リボソームとプロテアソームというタンパク質の生と死を司る分子同士の相互調節という点でも興味深い論文となりました。
さて、これまでは細胞レベルの分子研究を中心に進めて参りましたが、本プロジェクト研究では、動物モデルやケミカルバイオロジーを用いた新しい研究に挑戦したいと考えております。まず、個体レベルでのプロテアソーム研究です。2017 年、ドイツの病院連携研究グループにより発達障害の小児患者10例からプロテアソーム遺伝子のde novo変異が同定されました。プロテアソームは全ての細胞の生存に必須なので、ノックアウトマウス等を用いた解析は困難でしたが、当研究所の動物実験開発室のご協力の下、患者由来の変異をもつプロテアソーム変異マウスの作出に成功しました。これは世界初となる全身性のプロテアソーム機能低下マウスであり、今後、プロテアソームが関与する様々な疾患の発症機構解明に貢献できると期待しております。
2つ目は、最先端プロテオミクスの導入です。ユビキチ ン・プロテアソーム系で分解されるタンパク質は約6,000種類(ヒトプロテオームの約30%)と見積もられており、これまで網羅的な解析が困難でした。そのため、p97やRAD23、UBE3Aなどは、いずれも疾患関連因子にも関わらず基質特異性などについて不明な点が多く残されています。そこで、私が領域代表を務める新学術領域研究ケモユビキチンで最新鋭の質量分析計を研究所に設置させていただきました。遠藤彬則研究員が高深度比較プロテオーム解析法を開発し、現在、最大16サンプルから8,000種類以上のタンパク質を網羅的に同定定量することが可能となっております。本方法は非常に有用ですので、プロテアソーム制御分子の機能解析を進めるとともに、所内でも共同研究を進めることで研究所に貢献したいと考えております。3つ目は、ケミカルバイオロジーを用いたユビキチン・プロテアソーム研究です。プロテアソーム阻害剤は血液がんである多発性骨髄腫の治療薬として大きな成功を収め、 現在、選択的タンパク質分解誘導剤PROTAC(Proteolysis Targeting Chimera)を筆頭に、ユビキチン創薬が世界中で進展しております。私たちも、p97補助因子やプロテアソーム制御分子の阻害剤開発を進めており、これらは基礎 研究に有用なだけではなく、将来的に創薬シーズとなる可能性があります。
最後になりますが、ユビキチン・プロテアソーム系は広範な細胞機能を制御しているため、都医学研で実施されている多くの研究とも密接に関係しております。先生方のご研究でタンパク質分解が鍵を担っているようなことが御座いましたら、いつでもお声がけください。また、本プロジェクトでは、タンパク質分解研究を深化させるべく、常に新しいことに挑戦しております。特に、門前の小僧として開始した個体レベルでのプロテアソーム研究は不得手で御座いますので、是非、ご指導ご鞭撻の程よろしくお願いいたします。