
Jul. 2020 No.038
特集
Topics
開催報告
新型コロナに科学で立ち向かう都医学研
編集後記
Topics
不要なタンパク質が分解を受ける前に解きほぐされる仕組み ~ユビキチン関連疾患の正確な理解につながることが期待~
英国科学誌「Nature Communications」に蛋白質代謝プロジェクトの土屋光主任研究員らが「不要なタンパク質が分解を受ける前に解きほぐされる仕組み」について発表しました。
蛋白質代謝プロジェクト 主任研究員土屋 光
1.研究の背景
ユビキチンは高度に保存されたタンパク質で、標的タンパク質に目印として付加される事でタンパク質の運命を決定します。多くの場合、ユビキチンが数珠つながりになってユビキチン鎖 *1 を形成します。ユビキチン鎖はユビキチンのC末端のグリシン残基と、別のユビキチンのN末端アミノ基、もしくはリジン (Lys) 側鎖のアミノ基が共有結合を形成し合成されますが、結合に使われる残基によって異なる機能を持ちます。細胞内で最も多く存在するLys48鎖は、プロテアソーム *2 により分解・除去される目印として働きます。プロテアソームはしっかりとした構造のタンパク質を分解することが苦手なため、多くの場合前準備として、Lys48鎖で標識されたタンパク質はCdc48によって解きほぐす必要があります(図 1)。Cdc48は2つの補因子、Ufd1とNpl4とともに働きますが、Ufd1は複合体の安定化、Npl4がLys48鎖を特異的に認識する機能を持ちます。しかしながら、Ufd1とNpl4がどのように結合しているのかは不明でした。また、Npl4がどのようにLys48鎖を認識しているのかも不明でした。
2.研究の概要
私たちは、東京大学定量生命科学研究所の深井周也准教授と共同で、Lys48鎖二量体とNpl4の共結晶を作製し立体構造を決定しました(図2、左)。2つのユビキチンのうち、別のユビキチンに結合している方を遠位のユビキチン、結合されている方を近位のユビキチンと呼びます。Npl4は遠位近位のユビキチンを同時に認識していましたが、変異体解析により遠位のユビキチンが特に結合に重要である事が明らかになりました。一方、近位のユビキチンはNpl4のLys48鎖特異性に関わることがわかりました。また、Ufd1とNpl4とが結合した状態の結晶についても立体構造を決定しました(図2、右)。今回構造決定に用いたUfd1はアミノ酸20残基に満たない非常に短い領域でしたが、Npl4表面の溝にはまり込むように強く結合していました。
3.社会的意義と今後の展望
プロテアソームの機能低下はがんや神経変性疾患と密接に関わっており、プロテアソームの阻害剤は抗がん剤として用いられています。プロテアソームの上流で機能するCdc48もまた、有用な抗がん剤の標的となると注目されています。Cdc48の補因子であるUfd1とNpl4との結合を阻害することで Cdc48の機能を阻害できるため、本研究で得られた複合体の立体構造は、将来的に抗がん剤開発の基盤となることが期待されます。
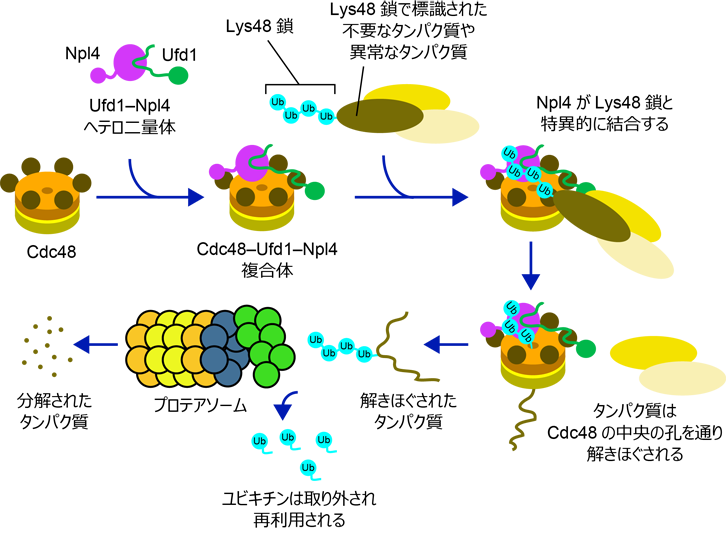
図1. プロテアソームによるタンパク質分解におけるCdc48のはたらき
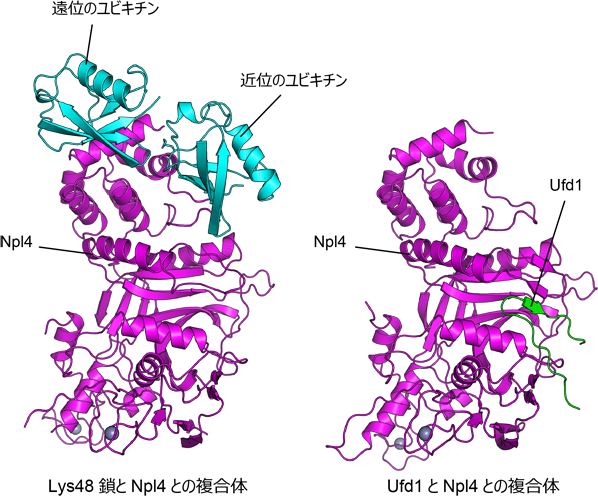
図2. Lys48鎖とNpl4との複合体、およびUfd1とNpl4との複合体の結晶構造
用語解説
- * 1:ユビキチン鎖
- ユビキチンは、基本的に標的タンパク質の特定のリジン残基に共有結合を介して付加される。ユビキチン自身も標的タンパク質の一つであるため、ユビキチン同士が結合して数珠つなぎになった ユビキチン鎖を形成する。
- * 2:プロテアソーム
- 細胞質や核内の不要なタンパク質を分解する、筒状の巨大な酵素複合体。ユビキチン鎖により標識されたタンパク質を選択的に分解することで様々な生命現象を制御する。

