
Jul. 2020 No.038
特集
Topics
開催報告
新型コロナに科学で立ち向かう都医学研
編集後記
Topics
皮膚バリア形成に必須な結合型セラミドを作るメカニズム
細胞膜研究室の平林哲也主席研究員は、名古屋大学の秋山真志教授らの研究グループ、Vanderbilt大学のAlan R. Brash教授らの研究グループとの共同研究で「皮膚バリア形成に必須な結合型セラミドを作るメカニズム」について、米国科学誌「The Journal of Clinical Investigation」に発表しました。
細胞膜研究室 主席研究員平林 哲也
皮膚の最外層である角質層は、外界からの異物侵入や体内水分の喪失を防ぐバリア機能を備えており、この機能が 障害されると先天性魚鱗癬*1やアトピー性皮膚炎などの原因となります。角質層は、1高度に架橋された周辺帯タンパク質に包まれた「角質細胞」と、2「角質細胞間脂質」*2から構成されますが(図A)、両者はそれぞれタンパク質と脂質という異質な成分であり、これらがバラバラのままではバリアとして十分に機能できません。そこで、両者を強固に繋ぎ止めるために、脂質の中でも特殊な構造を持つアシルセラミド*3(図B)を原料として、結合型セラミドを主成分とする角質細胞脂質エンベロープ(corneocyte lipid envelope:CLE)を作り、皮膚バリアを完成させているのです(図A)。しかしながら、結合型セラミドの化学構造や形成メカニズムの詳細は不明でした。
本研究では、SDR9C7遺伝子に変異を持つ先天性魚鱗 癬患者とSdr9c7遺伝子欠損マウスにおいてCLEが形成されないことを発見し、SDR9C7の酵素活性によって作り出される機能性脂質を同定することで、CLE形成の仕組みを提唱しました。これまでの研究で、CLEが作られる過程において、12R-LOXとeLOX3という2つの酵素によってアシルセラミドのリノール酸部分が修飾され、エポキシアルコール型が生じることが分かっていました(図C)。ところが、Sdr9c7欠損マウスではエポキシアルコール型がむしろ増加しており、これまで注目されていなかったエポキシケトン型がほぼ完全に消失していました。さらに、野生型SDR9C7酵素はエポキシアルコール型の水酸基をケトン基に変換する脱水素反応を触媒するのに対し(図C)、先天性魚鱗癬患者で見られる変異型SDR9C7酵素はこの活性を失っていることを突き止めました。SDR9C7によって産生されるエポキシケトン型アシルセラミドの官能基は反応性が非常に高いため、非酵素的に周辺帯タンパク質と架橋すると予想されます。
本研究成果により皮膚バリア形成機構の理解が一層進むことで、難病である先天性魚鱗癬や、バリア機能の低下が原因となるアレルギー疾患の病態解明や新規治療法の開発に貢献することが期待されます。
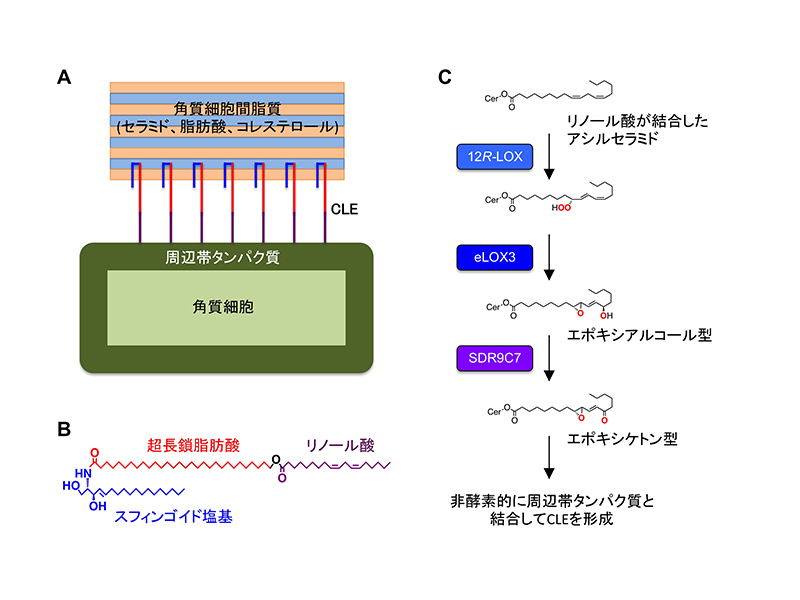
図. 皮膚バリアとアシルセラミド代謝経路
(A)皮膚バリア機能に不可欠な角質層の主要構成要素の模式図。
(B)アシルセラミドの基本骨格構造。
(C) アシルセラミドからCLE形成に至る代謝経路。セラミド(Cer)に結合したリノール酸部分が、12R-LOXとeLOX3による修飾反応を経て、エポキシアルコール型となる。さらにSDR9C7による水酸基の脱水素反応でエポキシケトン型に変換される。この官能基は反応性が高く、非酵素的にシステイン残基、ヒスチジン残基、リジン残基などと共有結合できる。
用語解説
- * 1:先天性魚鱗癬
- 生まれつき皮膚バリア機能が障害され、角質層が分厚く硬くなる稀な遺伝性皮膚疾患。厚生労働省の指定難病に指定されている。
- * 2:角質細胞間脂質
- セメントのように角質細胞同士の間を埋める脂質成分。主にセラミド、脂肪酸、コレステロールで構成される。
- * 3:アシルセラミド
- 表皮に存在する特殊な化学構造のセラミド。
炭素数30〜38程度の超長鎖脂肪酸のω末端に、必須脂肪酸のリノール酸がエステル結合する。

