
2017年12月14日
「Journal of Neurochemistry」on-line版に新見直子研究員らが 「糖尿病性神経障害の病態に関与するアルドース還元酵素の遺伝子欠損シュワン細胞株を樹立」 について発表しました。
糖尿病性神経障害の病態に関与するアルドース還元酵素の遺伝子欠損シュワン細胞株を樹立
糖尿病性神経障害プロジェクトの新見直子研究員、三五一憲プロジェクトリーダーらは、弘前大学の水上浩哉教授、八木橋操六特任教授、香港大学のSookja K. Chung教授らとの共同研究により、アルドース還元酵素遺伝子欠損マウスより不死化シュワン細胞株を樹立し、その特性を明らかにしました。研究成果は、2017年12月14日にJournal of Neurochemistryにオンライン掲載されました。
- <論文タイトル>
- A spontaneously immortalized Schwann cell line from aldose reductase-deficient mice as a useful tool for studying polyol pathway and aldehyde metabolism
- <発表雑誌>
- 「Journal of Neurochemistry」、 2017年12月14日
http://onlinelibrary.wiley.com/doi/10.1111/jnc.14277/full
1.研究の背景
糖尿病は、インスリンの効果不足によって筋肉や脂肪組織におけるグルコース(ブドウ糖)の取り込みと利用が障害されて引き起こされる、全身の代謝病です。筋肉や脂肪組織と異なり、末梢神経はグルコースの取り込みにインスリンを必要としません。そのため糖尿病では、末梢神経を構成するニューロンやシュワン細胞(*1)へのグルコース流入が増加し、余剰のグルコースはアルドース還元酵素 (AR)の働きでソルビトールやフルクトースという物質に変換されます(ポリオール代謝)。このポリオール代謝が亢進することにより、最終糖化産物(*2)や活性酸素が産生され、糖尿病性神経障害(*3)の原因になると考えられています(図)。香港大学のChung教授らは、弘前大学の八木橋教授らとの共同研究により、「AR遺伝子欠損マウスは末梢神経系に明らかな異常を示さず、また高血糖状態では野生型マウスに比べ、神経障害の進行が抑制される」ことを報告しています (Ho et al., Diabetes 2006) 。ARの活性を阻害する薬剤も開発され、神経障害治療薬として臨床応用されています。一方で、ARは生体内で生成された毒性アルデヒドを解毒するという生理機能を有していますが、末梢神経系におけるARの役割は解明されていません。
<図>
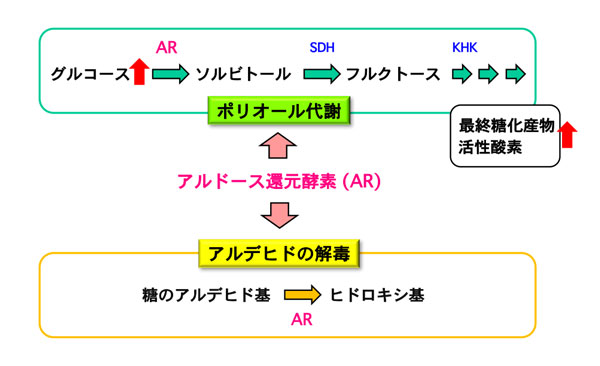
<図の説明>
ARはポリオール代謝の最初の酵素として、過剰なグルコースをソルビトールに変換します。高血糖に伴うポリオール代謝の活性化は最終糖化産物や活性酸素の増加をもたらし、糖尿病性末梢神経障害を引き起こす一因と考えられています。一方、ARは糖のアルデヒド基をヒドロキシ基に還元することにより、毒性の高いアルデヒドの解毒を担っています。
2.研究の概要
新見研究員らは、香港大学、弘前大学等との共同研究により、AR遺伝子欠損マウスの末梢神経組織を長期間培養し、自発的な不死化シュワン細胞株を樹立することに成功しました。この細胞株は、正常マウス由来の細胞株と同じように、シュワン細胞マーカーであるS100蛋白を発現しており、神経栄養因子を産生し細胞外に放出することが確認され、シュワン細胞としての特性を保持していました。一方、AR蛋白を欠くことにより、ポリオール代謝経路でARの下流に位置するソルビトール脱水素酵素(SDH)やケトヘキソキナーゼ(KHK)の遺伝子・蛋白発現量が著しく減少していました。対照的に、ARとともに毒性アルデヒドの解毒を担うと考えられる類縁酵素(アルド・ケト還元酵素、アルデヒド脱水素酵素)の発現量は増加していました。実際にヒドロキシノネナール等の毒性アルデヒドをAR欠損および正常シュワン細胞株に投与して生存率を比較しましたが、有意な差はみられませんでした。さらに毒性アルデヒドを負荷したAR欠損シュワン細胞株では、アルド・ケト還元酵素AKR1B7, AKR1B8の発現量がさらに増加していました。これらの酵素は、AR欠損シュワン細胞株において、ARの解毒機能を代償しているものと考えられました。
3.今後の展望
AR欠損シュワン細胞株を用いて、最終糖化産物や活性酸素の産生等を検討することにより、神経障害の成因を詳らかにしたいと考えています。特にポリオール代謝が機能しない場合に、どの代謝経路がより活性化されるのかを調べることで、末梢神経障害を効果的に低減できる治療薬の開発につなげていけるのではないかと期待しています。またAR阻害薬による重篤な副作用は報告されていませんが、これはAKR1B7, AKR1B8等が不活化されたARに代わって毒性アルデヒドの解毒を担うからではないかと推察されます。今後、遺伝子改変等によりこれらの酵素の機能を明らかにし、アルデヒドの解毒機構の解明につなげたいと考えています。
用語解説
- *1: シュワン細胞
- 末梢神経系のグリア細胞として、ニューロンの代謝を維持するとともに、神経線維の周囲を取り囲んでミエリン(髄鞘)を形成します。このミエリンとミエリンの間を神経の電気信号が伝わることにより、速い伝導(跳躍伝導)が可能となります。ミエリンの損傷や神経線維からの脱落(脱髄)は、末梢神経障害の原因となります。
- *2: 最終糖化産物
- タンパク質と糖が酵素を介さずに反応(糖化)して生成される物質の総称で、数十種類の化合物が知られています。糖化により蛋白質の機能が低下したり、活性酸素による細胞傷害が加速することで、糖尿病の症状を悪化させ慢性合併症の原因にもなると考えられています。
- *3: 糖尿病性神経障害
- 神経系は中枢神経系(脳・脊髄)と末梢神経系に大別されます。末梢神経系は中枢神経系からの情報を末端器官(手足、内臓、皮膚など)に伝え、また末端器官からの情報(触覚、温痛覚など)を中枢神経系に伝えます。糖尿病によりこの末梢神経が障害されると、しびれや痛み、筋力低下、排尿排便障害などが生じます。進行すれば生活の質が著しく低下し、治療意欲も減退してしまうため、末梢神経障害の予防や改善は糖尿病治療の上で重要な課題です。


