Oct. 2021 No.043
特集
Topics
開催報告
編集後記
特集
新プロジェクト紹介(体内時計プロジェクト)
体内時計プロジェクトリーダー吉種 光

2021年4月より新しいプロジェクトを発足させていただき、体内時計プロジェクトと名付けました。プロジェクトリーダーの吉種光と申します。私はこれまで東京大学 大学院理学系研究科 生物化学科の深田吉孝教授のもとで概日時計の分子メカニズムの研究に従事してきました。東大深田研の良いところを引き継ぎ、さらに独自性も出して発展させられるように頑張りますので、どうぞよろしくお願い申し上げます。
体内時計とは
プロジェクト名にも掲げた「体内時計」とは何でしょうか。TVなどでもしばしば紹介されているので聞いたことがある人もいると思います。我々専門家は概日時計(circadian clock)と表現します。地球上に生存するほとんど全ての生物には、約24時間周期で規則的に繰り返される生理現象(概日リズム、circadian rhythm)が観察されます。例えばヒトは睡眠覚醒のリズムだけではなく、体温や様々なホルモン分泌、代謝の活性などに時刻依存性が見られます。植物は太陽が昇る前に葉を上に向けて、光合成関連の遺伝子の活性を上昇させて朝日を待つかのようにスタンバイしています。これらは24時間周期でダイナミックに変動する地球の環境変化に適応するために生物が獲得した仕組みで、リズムが乱れるような変異体は生存に不利であり、自然淘汰されてきたと考えられています。上述したようにこれらリズムの周期は「約」24時間です。そのままでは毎日少しずつ環境サイクルからずれてしまうので、これを環境サイクルと同期させる時計入力(時刻合わせ機能)があります。例えばヒトは網膜で受容した光情報を脳の視床下部に伝えて、行動パターンを変化させます。これによって活動期に得た食餌シグナルが末梢組織の時計の針を調整しています。その一方で、概日リズムは明暗や温度、食餌のサイクルがないような環境にいる時でも自律的にリズムを刻み続けるという二面性があります。これは全身の細胞1つ1つの中で概ね1日周期で時計が回り続けているからであり、この仕組みは概日時計と呼ばれています。ちなみにcircadianという単語はラテン語のcirca(約、about)dies(1日、a day)に由来すると言われています。ここまで説明した上で冒頭に戻ると、「体内時計」とは何でしょうか。私たちの体の中には概日時計だけではなく様々な「時」を計り、規則的にリズムを繰り返す仕組みがあります。例えば、春に咲く花や、老化・寿命のような長い時間軸のものから、背骨の形成に必要な体節リズムや、心臓の鼓動のような短い時間軸のものまであります。このような「時」を生み出す体内時計の分子メカニズムに焦点を絞って、本プロジェクトを推進していきたいと考えています。
概日時計の仕組み
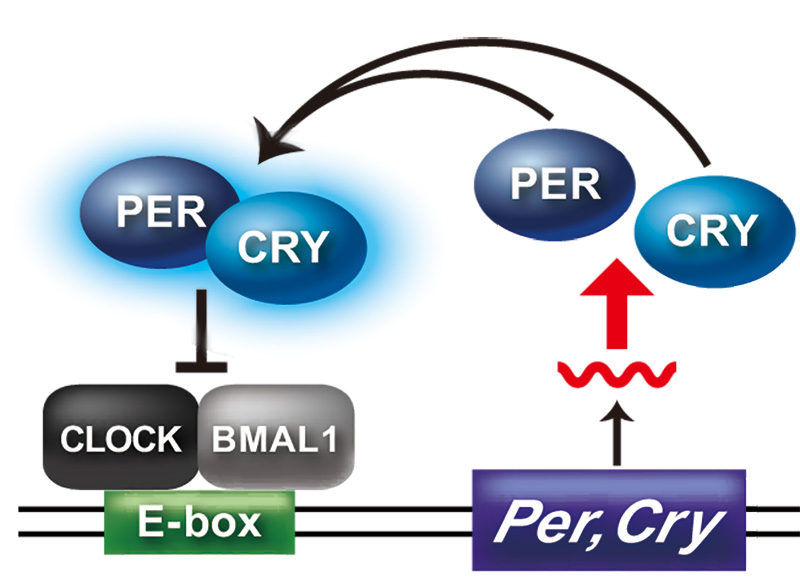
次に、本プロジェクトの中心的な研究課題である概日時計の分子的な仕組みについて説明したいと思います。約24時間周期のリズムを生み出す概日時計は、時計遺伝子の転写フィードバック制御を基本骨格とすると考えられ、2017年にはその分子メカニズムを発見した研究者らにノーベル生理学・医学賞が授与されました。哺乳類においては、CLOCKとBMAL1と呼ばれる2つのタンパク質がアクセルとして機能します。CLOCKとBMAL1が出会って合体すると(二量体を形成すると)特定のDNA配列を認識できるようになります。E-boxと呼ばれるDNA配列(CACGTGまたはその類似配列)はゲノム上に散在していますが、この配列を見つけると結合してその周辺の遺伝子の転写を活性化します。ゲノムを辞書に例えると、CACGTGというポストイットがついたページをCLOCKとBMAL1が見つけると、そのページを開くわけです。開いたページには遺伝子情報、つまりタンパク質を作るためレシピが書かれています。中でもPeriod(Per)やCryptochrome(Cry)と呼ばれる時計遺伝子が重要なブレーキ役を果たします。朝にPerやCryのページが開かれると次々とPERやCRYタンパク質が作られて、夜には細胞の中にタンパク質が溜まっていきます。PERやCRYタンパク質はCLOCKとBMAL1に出会うと、本を開くのを邪魔して、そっと本を閉じてしまいます。すると、PerやCryのページも閉じられてしまうので、PERやCRYタンパク質が作られなくなり、徐々に分解されてその量が少なくなってきます。PERやCRYタンパク質が細胞からいなくなると、次の朝にはまたCLOCKとBMAL1が本を開くためにポストイットを探しに向かうわけです。このアクセルとブレーキのリズムが全身の細胞1つ1つの中で約24時間という時間を計っているのです。Period遺伝子を発見して、この転写フィードバック制御の仕組みを提唱した研究者たちにノーベル賞が授与されましたが、このモデルは本当に正しいのでしょうか。シアノバクテリアでは、3つの時計タンパク質とATPを混合すると、試験管内でも概日時計が振動することが知られていて、真核生物においても、転写リズムがない状態における約24時間周期のリズムが報告されています。転写フィードバック制御は時計の振動を外部に伝えるいわば時計の針としての役割を担っており、分子間相互作用・翻訳後修飾・酵素活性・立体構造変化などのタンパク質ダイナミクスが概日時計のクオーツ(circadian quartz)として機能しているのかもしれませんね。
概日時計の機能破綻と老化
概日時計の獲得は進化上有利に働いたと考えられていますが、それでは実際に概日時計が壊れると私たちの身体の中では何が起こるのでしょうか。全身のそれぞれの組織において数多くの遺伝子に概日リズムが見られることからわかるように、概日時計がうまく機能しないとこれら遺伝子の機能異常から様々な疾病リスクが上昇します。例えば、Bmal1欠損マウスは若齢においても白内障や軟骨脱落などの早期老化様の症状を示し、寿命も約9ヶ月と短縮します(マウス本来の寿命は2-3年)。また、生活習慣の乱れによっても概日時計の正常な機能が破綻して同様の症状が観察されます。概日時計が破綻した際に引き起こされるこれらの症状は、加齢に伴う生理機能の低下や疾病などの「老化現象」と酷似していることに我々は着目しました。近年、医療の発達に伴って国際レベルで高齢化が加速しています。医療負担を削減するためにも健康長寿を目指す必要がある中で、個々の老化現象ではなく、老化の引き金となる根本の分子メカニズムの理解とその克服は重要な研究課題です。体内時計プロジェクトでは、加齢に伴う概日時計の異常を「clock aging(時計老化)」と定義し、加齢に伴う多臓器の機能低下、すなわち老化現象は時計老化によるリズム出力異常が原因なのかもしれないと考えています。これを克服することができれば、究極のアンチエイジングが可能になると期待しています。概日時計の振動原理を分子レベルで理解する概日時計クオーツプロジェクトと老化の根本を理解する時計老化プロジェクトを両輪に、都民のみなさまに研究成果を還元できるようプロジェクトメンバーで一致団結して頑張って参りますので、どうぞよろしくお願い申し上げます。