
2014年5月1日
英国科学雑誌「Nature(ネイチャー)」に蛋白質リサイクルプロジェクトリーダーの松田憲之副参事研究員・佐伯泰副参事研究員、田中啓二所長らの研究成果が発表されました。
パーキンソン病の発症を抑制する細胞内の小分子を発見
-病理解析や診断マーカーの開発につながる発見-
公益財団法人 東京都医学総合研究所蛋白質リサイクルプロジェクトリーダーの松田憲之副参事研究員と佐伯泰副参事研究員、田中啓二所長らのグループは、徳島大学 藤井節郎記念医科学センターの小迫英尊教授、名古屋大学 物質科学国際研究センターの田村康准教授、静岡大学 農学研究科の木村洋子教授、産業技術総合研究所 創薬分子プロファイリング研究センターの広川貴次チームリーダー、JST-CREST及び京都産業大学 生命システム学科の遠藤斗志也教授、カナダ・マギル大学(McGill University)のEdward Fon博士、Jean-Francois Trempe博士との共同研究によって、リン酸化※1されたユビキチン※2という細胞内に存在する小さなタンパク質が、遺伝性パーキンソン病※3の発症を抑えるために働く分子であることを世界で最初に明らかにしました。
ユビキチンは細胞内で様々な機能を担う小さな(低分子の)タンパク質であり、その機能に関しては膨大な数の論文が報告されています。しかしながら、「ユビキチンがリン酸化されて、それが細胞内でパーキンソン病の発症を防ぐのに重要な役割を担っている」ことは、誰も予想だにしなかった全く新しい発見です。この研究成果は、英国科学雑誌「Nature(ネイチャー)」の4月30日(英国現地時間)付オンライン版で発表されました。純粋に基礎科学の成果として大変に重要な発見であると同時に、医療の場面においてパーキンソン病の早期診断法として新たな開発に寄与することが期待されます。
1.研究の背景
パーキンソン病は、神経伝達物質であるドーパミンを産生する神経細胞が失われることにより、安静時のふるえや歩行障害(すり足,小股、前屈姿勢など)、姿勢保持障害(例えば歩き出したり後方に引かれたりすると、止まれずに突進してしまう)、動作緩慢(動きが遅くなったり少なくなることで、細かい作業が困難になる)など様々な運動障害が起こる病気です。病状が進行すると自律神経障害、記憶力低下などの認知機能障害、幻視やうつなどの精神症状が表れることもあり、最終的に自立した生活が困難になり、車いすや寝たきりの生活になる危険性があります。
パーキンソン病は日本国内だけでも15万人を超える患者がいる難治性の神経変性疾患※4であり、また高齢者ほど患者数が多く、65歳を超えると1%以上の人が罹患するといわれています。社会の高齢化が進むにつれて患者数は増え続けており、病気が発症する仕組みの解明と、早期診断法や根本的な治療法の確立が社会的に強く求められています。
パーキンソン病にはいくつかのタイプがあり、発症原因も単一ではないと考えられていますが、PINK1やParkinという遺伝子(及びその遺伝子によって作られるPINK1タンパク質やParkinタンパク質)が変異しますと、パーキンソン病を若くして発症します(遺伝性若年性パーキンソン病といいます)。遺伝子の変異によってPINK1やParkinの機能が失われると発症するので、これらの遺伝子は “パーキンソン病の発症を抑えるために働いている”ことが判っています。PINK1は標的となるタンパク質にリン酸※1を付加するタンパク質リン酸化酵素(プロテインキナーゼ)、Parkinは標的タンパク質にユビキチン※2を付加するユビキチン連結酵素です。
松田憲之プロジェクトリーダーと田中所長らのグループは「PINK1 と Parkin の機能を調べればパーキンソン病の発症機構に迫れるのではないか」と考えて10年近く研究を続けており、2010年には Parkin と PINK1 が協調して細胞内のミトコンドリア※5の品質を維持するために働いていること[ジャーナル・オブ・セルバイオロジー誌(JCB誌)に発表]、2012年には PINK1 が自分自身をリン酸化することがミトコンドリア異常を伝える最初の出来事であること(ネイチャー・コミュニケーションズ誌に発表)を報告していました。しかしながら、PINK1とParkinの両者を結びつける分子の実体が不明であり、最大の謎と言われ、この「ミッシングリンク」の発見・同定がこの分野に残された課題でした。
2.研究成果の概要
本研究は、この分野の研究者にとって積年の謎であった「PINK1とParkinを結びつける分子」を発見し、細胞がパーキンソン病の発症を抑える仕組みを解明したものです。 松田プロジェクトリーダー・田中所長らの研究グループは、細胞内でミトコンドリアの品質が低下した時に、PINK1キナーゼがユビキチンをリン酸化し、このリン酸化ユビキチンがParkinを活性化することで遺伝性パーキンソン病の発症を抑えていることを、世界で初めて明らかにしました。言い換えると、PINK1 が細胞の中で「このミトコンドリアが異常です」という情報をどのようにして伝達するのかを、「ユビキチンのリン酸化」という分子のレベルで解明したとも言えます。遺伝性パーキンソン病の患者由来のPINK1(患者の変異を有する PINK1)はユビキチンをリン酸できずに、Parkinを活性化することができません。この経路が障害されると、どのミトコンドリアが不良品であるかという情報が細胞の中で正しく伝わらず、異常なミトコンドリアが処分されないために※6、脳内のミトコンドリアの品質が低下して、パーキンソン病が発症すると考えられます(図参照)。つまりリン酸化ユビキチンは遺伝性パーキンソン病の発症を抑える為に働く分子です。
図:本研究で明らかにされたリン酸化ユビキチンの機能
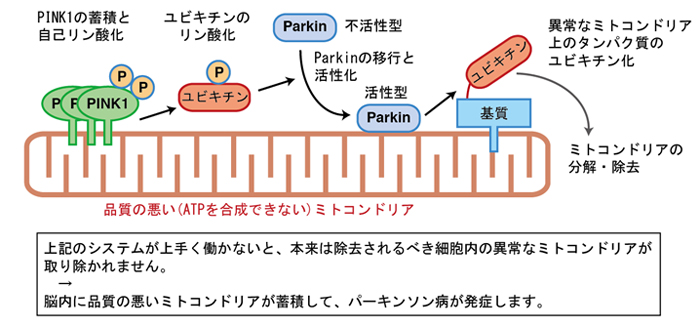
図の説明:
正常な状態では、PINK1がユビキチンをリン酸化してParkinを活性化することで、細胞内の異常なミトコンドリアが除去されます。一方で、この機構が破綻すると異常なミトコンドリアが脳内に徐々に蓄積し、パーキンソン病の発症に至ります。なお、Parkinが付加するユビキチン(図の右側)は、必ずしもリン酸化されている必要はありません。ただし、PINK1→リン酸化ユビキチン→Parkinの活性化→ユビキチンがミトコンドリア上に集積→そのユビキチンをPINK1がさらにリン酸化→Parkinの活性化・・・という正のサイクルが形成されて、それがシグナルを増幅させていると予想されます。
2.研究成果の概要
<基礎研究としての意義>
ユビキチンに関しては既に1万報以上の論文が報告されていますが、ユビキチンのリン酸化やその生理的な意義が示されたのは世界初であり、純粋に基礎科学の観点から興味深いものです。また、本研究を通じて、リン酸化ユビキチンがPINK1とParkinを結びつける鍵因子であることが明らかにされて、遺伝性パーキンソン病の発症メカニズムの理解が飛躍的に進みました。本成果は遺伝性パーキンソン病に関するものですが、より一般的な孤発性パーキンソン病についても同様の仕組みが発症に関与している可能性は十分にあります。
<応用研究としての意義>
新しいパーキンソン病の病理解析ツールや診断マーカーの開発につながる発見であると考えられます。本研究ではPINK1によるユビキチンのリン酸化部位を決定しているので、そのリン酸化ユビキチンに由来する信号を質量分析装置で捉えることによって、放置するとパーキンソン病の発症につながるような‘細胞内のミトコンドリア異常’を知らせる信号を高感度で検知することが期待できます。なお、将来的にはパーキンソン病の治療薬のスクリーニングへの応用も期待されますが、長期的な視野で考えなければいけない課題であり、10年程度の長い時間がかかることが予想されます。
【用語説明及び補足】
- ※1 リン酸化:
- 細胞の中では、リン酸(化学式H3PO4)という物質をタンパク質に付けたり(リン酸化)、外したり(脱リン酸化)することで情報が伝達されます。リン酸を別な物質に付ける働きを持つタンパク質をリン酸化酵素(キナーゼ)と呼び、PINK1は標的タンパク質にリン酸を付加するプロテインキナーゼに分類されます。なお、キナーゼはカイネースと呼ばれることもあります。
- ※2 ユビキチン:
- 酵母からハエ・動物・ヒトにいたるまで、生物界で非常によく保存された小さなタンパク質であり、細胞の中で他の標的となるタンパク質に結合(修飾)することで機能します。特に良く知られた機能は、標的タンパク質を分解に導く「細胞内分解シグナル」としての機能です。実際2004年には「ユビキチンを介したタンパク質分解の発見」の功績により、Aaron Ciechanover博士、Avram Hershko博士、Irwin Rose博士がノーベル賞を受賞しています。
田中所長はユビキチンが付加されたタンパク質を分解する酵素(プロテアソーム)の発見者であり、ユビキチン・プロテアソーム系をライフワークとして研究しています。 - ※3 パーキンソン病:
- ふるえや手足のこわばり、歩行障害、動作緩慢、転びやすさなどの症状がある神経変性疾患のひとつ。治療は症状を緩和する薬物治療が基本で、様々な運動療法によるリハビリテーションと組み合わされることが多いです。現在行われている治療法は脳内で不足するドーパミンを補う対症療法であり、根本的な治療法はまだ見つかっていません。
パーキンソン病は孤発性のものと、遺伝性のもの(遺伝性パーキンソン症候群とも呼ばれます)に大別されます。患者の大部分(8?9割)は孤発性のパーキンソン病に分類されますが、環境要因や生活習慣を含めて多面的な因子が発症に関与するので、病気の原因を絞り込むことが困難です。一方で、遺伝性のパーキンソン病が患者全体に占める比率は1?2割と考えられますが、病気の原因が単一遺伝子の変異であり、病気と発症原因の因果関係がはっきりしています。 - ※4 神経変性疾患:
- 主に成人期以降に発症する脳の病気で、特定の神経細胞が異常になって死んでしまう(神経が変性して脱落する)ことが原因で発症します。パーキンソン病のほか、アルツハイマー病、筋萎縮性側索硬化症(ALS)、ハンチントン病などがあります。
- ※5 ミトコンドリア:
- 細胞の中に存在する小さな小部屋(細胞小器官/オルガネラ)の一つ。細長い二重の膜で包まれた袋状の構造体で、人間が生きていくために必要なエネルギー(アデノシン三リン酸:ATP)を産生する場所なので「細胞内のエネルギー産生工場」や「細胞内の発電所」とも言われます。ATPを産生できないミトコンドリアは「不良品」であり、このようなミトコンドリアを処分するためにPINK1やParkinが機能しています。
- ※6 異常なミトコンドリアの処分:
- PINK1とParkinが細胞の中で異常なミトコンドリアの処分を担います。簡潔に言うとPINK1はミトコンドリアが異常であるかどうかを調べて連絡する係、Parkin はその異常ミトコンドリアに分解の目印を付ける係です。そのことは 2010年に本研究を行った田中所長/松田憲之プロジェクトリーダーらのグループを含む、国内外の多数の研究者によって証明されました。
- 「補足」
- 今回の発見に直接関係しないので省略しましたが、PINK1はユビキチンのみならずParkinもリン酸化します(ジャーナル・オブ・バイオロジカルケミストリー誌(JBC誌) 2013年に発表済)。Parkinのリン酸化とユビキチンのリン酸化と、2つのリン酸化修飾が合わさることで、Parkinは活性型に転換されます。


