
2014年12月16日
米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS) 米国科学アカデミー紀要」にカルパインプロジェクトの反町洋之参事研究員・小野弥子主席研究員らの研究成果が発表されました。
カルパイン3が筋ジストロフィーを防ぐための新奇なメカニズムを発見
~筋ジストロフィーの新たな治療法の可能性~
(公財)東京都医学総合研究所の小野弥子(オノ ヤスコ)主席研究員、反町洋之参事研究員らは、米アリゾナ大学のCarol C. Gregorio教授との共同研究により、筋ジストロフィーの責任遺伝子産物であるカルパイン3が通常の骨格筋を守る(=筋ジストロフィーを防止している)新奇な分子メカニズムを明らかにしました。
カルパイン3は動物の筋肉(骨格筋)に発現するカルパイン*1で、タンパク質を切断する酵素(プロテアーゼ)です。 筋肉の疾患である筋ジストロフィー*2の一種は、カルパイン3の遺伝子変異によって、この酵素の活性(タンパク質を切断するという働き)が不全となるために発症します。 本研究では「正常なカルパイン3の働き」を明らかにするため、筋ジストロフィーの症状とカルパイン3遺伝子変異の関係について新たな視点から解析しました。 カルパイン3は、試験管内では自己を分解する強い活性を持つ大変不安定な酵素ですが、筋肉中では2つの断片に切断され、いったん活性を失った後、再び会合して活性を回復して機能しうることを発見しました。 このようなプロテアーゼの性質は、ウイルス以外の生物では初めての報告です。 つまり、カルパイン3が一見とても不安定なことは、筋肉の中でうまく働くために必要な性質であり、これが「筋ジストロフィーを発症しない状態」の維持に寄与すると考えられました。 この性質の発見により、筋ジストロフィーの治療法として全く新しい可能性を示すことができました。
この研究成果は、米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS) 米国科学アカデミー紀要」の12月15日午後3時(米国東部時間)付オンライン版で発表され、さらに1月発行予定の「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」誌に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
若手研究(B)
| 研究課題名 | 「骨格筋特異的なカルパインシステムの機能と制御機構の解析」 |
|---|---|
| 研究者 | 小野 弥子(公益法人東京都医学総合研究所 主席研究員) |
| 研究期間 | 平成22年4月~平成24年3月 |
東レ科学技術研究助成
| 研究課題名 | 「骨格筋特異的カルパインの活性化による筋ジストロフィー発症防止機構の解明」 |
|---|---|
| 研究者 | 小野弥子(公益法人東京都医学総合研究所 主席研究員) |
| 研究期間 | 平成24年4月~平成27年3月 |
基盤研究(A)
| 研究課題名 | 「組織機能論的なカルパイン作用機序の解析とその普遍性抽出」 |
|---|---|
| 研究者 | 反町洋之(公益法人東京都医学総合研究所 参事研究員) |
| 研究期間 | 平成23年4月~平成26年3月 |
武田財団科学奨励費
| 研究課題名 | 「三大タンパク質分解システムの相互関連とその破綻による病態の解明」 |
|---|---|
| 研究者 | 田中啓二(公益法人東京都医学総合研究所 所長) |
| 研究期間 | 平成26年4月~平成27年3月 |
1.研究の背景と経緯
筋肉(骨格筋)は私たちの身体の中で最大の器官であり、自由な動作を実現しているだけでなく、形態維持、体温維持、血糖値調節、飢餓時の栄養源など幅広い働きにより、私たちの生命維持に欠くべからざるものとなっています。 その八面六臂の活躍故に、筋肉は絶えず多くのストレスに曝されており、多数のタンパク質が協働して筋肉をストレスから守っています。 カルパイン3もその一つで、筋肉がいつも健康でいられるようにストレスの見張り役となり様々な調節を行っています。 そのため、カルパイン3の遺伝子に変異が生じるなどしてカルパイン3の働きが不全となると、筋肉が徐々に萎縮、壊死していってしまう「筋ジストロフィー」という病気になってしまいます。 カルパイン3は他のタンパク質を切断することでそれらの新しい機能を引き出す、調節的なタンパク質分解酵素(プロテアーゼ)です。試験管の中では自分で自分を切断してしまい、5分程度でバラバラになってしまうとても不安定な酵素で、これまで、このような不安定な酵素がどのように筋肉を守ることができるのか、詳しい分子メカニズムは不明でした。
そこで、カルパイン3がなぜ自分自身を分解してしまうのか、それが筋肉を守るために、どのような意味を持っているのか、といった点について、様々な生化学的実験によって詳しく調べることにしました。 その結果、カルパイン3は自身を速やかに切断して、その活性(他のタンパク質を切断する、という酵素の働き)を失ってしまうのですが、その後、切断された断片同士が再び会合して組み合わさり、合体ロボのように新たな活性を持つ酵素として働く、という驚くべき事実が判明しました。 このような性質を持つプロテアーゼの存在は、ごく一部のウイルスで知られていますが、動物を含めた全ての生物(ウイルスは含まない)において初めての例です。
2.研究の概要
全てのプロテアーゼはタンパク質を分解する酵素なので、多かれ少なかれ自分自身も分解しますが、カルパイン3のように激しく、急速に自己を分解する酵素は他に知られていません。 筋肉の中では全長の1/3ぐらいの所でまず切断を受け、2つの断片に分解されます。 この時点で、カルパイン3のプロテアーゼとしての活性・役割は終わるとされてきました。 私たちは、筋ジストロフィーの症状とカルパイン3遺伝子変異の関係をヒントに、分解された2つのカルパイン3の断片どうしが組み合わさって、活性を回復する可能性はないのか?と考えました。 試験管や細胞の中で、2つの断片を一緒にして条件を検討したところ、まさに活性が回復されることを明らかとしました。 さらに、一つのアミノ酸変異によって活性を失ってしまった(ヒトで起これば筋ジストロフィーを発症してしまう)ようなカルパイン3を作製し、これに上記の2つの断片の片方(これだけでは活性はない)を混合すると、失われていたカルパイン3の活性が回復することも発見しました。
以上の性質は大変ユニークなものですが、これが筋肉を守るためにどのように働いているかについては、さらに研究が必要です。 しかし、カルパイン3が強いプロテアーゼであること、カルパイン3は比較的大型の酵素であること、筋肉の中には筋原線維と呼ばれるタンパク質の束がぎっしりと詰まっていること、などを考え合わせると、次のように予想されます: ①素速い自己分解活性はカルパイン3がやたらに他のタンパク質を分解しすぎないようにする第一の安全弁として大切な性質であり、 ②2つの断片に分割するのは、筋肉の内部にもカルパイン3を必要とするタンパク質が存在し、そこに到達しやすいように、また、到達してからはじめて活性が出るようにするために重要であろう、ということです。
3.今後の展望
本研究から、カルパイン3が大変不安定な酵素であることに、大きな意味の有ることが示唆されました。 同時に、カルパイン3の遺伝子に変異があり、活性が失われたために筋ジストロフィーとなっている場合に、分解によって生じる2つの断片のうち、どちらか適当な方と同じ部分を補うことにより、活性を回復できる可能性が示されました。 これは、カルパイン3遺伝子の変異で筋ジストロフィーとなっている場合の新たな治療法の可能性を示唆するものです。 現在までの研究では、カルパイン3が強いプロテアーゼのため、活性のある(野生型の)カルパイン3を発現させるような遺伝子治療は、“過剰な活性”によるリスクを伴うことが示されています。 2つの断片は、それぞれ単体では全くプロテアーゼの活性を持たないため、比較的安全ではないかと考えられます。実際の治療までにはまだまだ多くの研究が必要ですが、今まで全く考えられていなかった可能性を示す事ができたことは、大きな意味が有ると考えられます。
【用語説明】
- ※1 カルパイン:
- ほとんど全ての細胞に存在するタンパク質の一種。特に、他のタンパク質または自分自身を分解(切断)することから、“プロテアーゼ”と呼ばれる酵素である(分解されるタンパク質を、基質タンパク質という)。人間には500種類以上のプロテアーゼ遺伝子があり、カルパインは15種類存在する。
- ※2 筋ジストロフィー:
- 年齢と共に筋肉が進行的に壊死、萎縮を呈する遺伝性の難病。様々な責任遺伝子(=それが変異すると病気になってしまうような遺伝子)が存在しており、発症原因の多様性を理解し、それに基づいた治療法が模索されている。カルパイン3を責任遺伝子とするものは肢帯型筋ジストロフィー2A型(LGMD2A)と呼ばれ、腹部に近い筋肉の萎縮が顕著である。
参考図
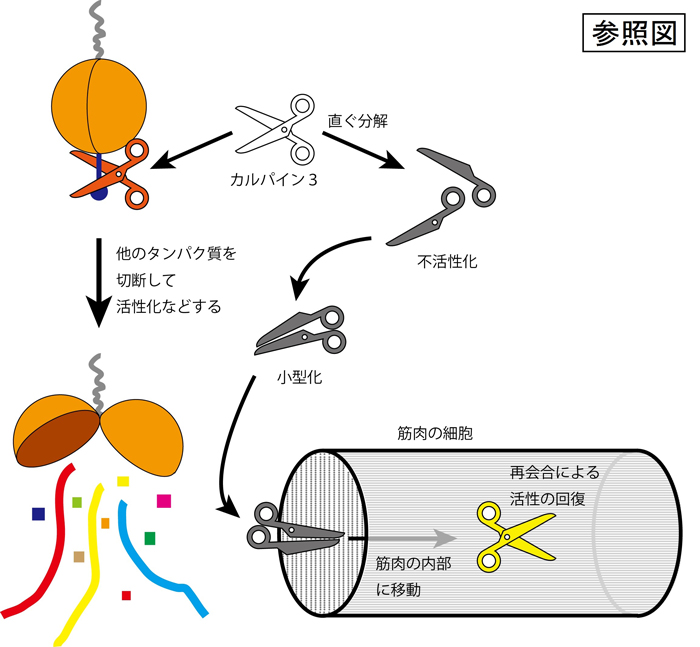
カルパイン3は他のタンパク質の一部を切断して、その状態を変化(活性化など)させることで働いている。カルパイン3の活性は強いため、必要なとき以外は、直ぐに自分で自分を分解して不活性な状態にしている。しかし、筋肉の内部で必要になると、分解した断片が筋肉の細胞(筋原線維というタンパク質の束が詰まっているので動きにくい)の内部まで入っていき、そこで合体して新たに活性を回復し、働く。
【論文情報】
雑誌名:Proc. Natl. Acad. Sci. U.S.A. (米国科学アカデミー紀要)
論文タイトル:The N- and C-terminal autolytic fragments of CAPN3/p94/calpain-3 restore proteolytic activity by intermolecular complementation.
著者: Yasuko Ono, Mayumi Shindo, Naoko Doi, Fujiko Kitamura, Carol C. Gregorio & Hiroyuki Sorimachi


