
2014年6月6日
米国科学誌「Cell Metabolism」に脂質代謝プロジェクトリーダーの村上誠参事研究員、佐藤弘泰研究員、武富芳隆研究員らの研究成果が発表されました。
脂肪細胞から分泌される脂質代謝酵素による肥満の新しい調節機構の発見
(公財)東京都医学総合研究所の村上誠参事研究員、佐藤弘泰研究員、武富芳隆研究員らは、脂質を分解する酵素ファミリーの生理的役割に関する研究を通じて、肥満の新しい調節機構を解明しました。 すなわち、脂肪細胞から分泌される2種の脂質分解酵素がそれぞれ肥満を改善または促進することを初めて見つけました。 本研究成果は、近年増加の一途を辿る肥満や糖尿病などのメタボリックシンドロームの新たな診断法や治療薬の開発につながることが期待されます。
なお、本研究は、熊本大学の尾池雄一教授、昭和大学の原俊太郎教授、米国ワシントン大学のMichael Gelb教授らとの共同研究により、独立行政法人 科学技術振興機構(JST) 戦略的創造研究推進事業チーム型研究(CREST)ならびに文部科学省科研費(新学術領域研究、基盤研究、若手研究)の一環として行われました。 本研究成果は、2014年6月5日(米国東部時間)に米国科学誌『Cell Metabolism』にオンライン掲載されます。
1.研究の背景
メタボリックシンドロームの病態基盤であるインスリン抵抗性※1は肥満に伴うことが多く、組織内に脂質が過剰に蓄積することが、脂肪毒性により細胞内ストレスや慢性炎症を引き起こし、インスリン抵抗性の要因となります。 脂質代謝の異常は肥満、高脂血症、インスリン抵抗性の病態に密接に関与することがわかっていますが、その全体像は十分理解されていません。 村上研究員らは、リン脂質代謝酵素の一群であるホスホリパーゼA2(PLA2)分子ファミリー※2の生理的機能に関する研究を進める過程で、肥満を調節する新しい仕組みを発見しました。
2.研究成果の要点
村上研究員らは、高脂肪食を与えて肥満になったマウスと通常食で飼育したマウスの脂肪組織における遺伝子発現をマイクロアレイ(発現遺伝子の網羅的解析)により比較し、肥満後に発現が誘導される脂質分解酵素を包括的に探索しました。 その結果、2種類の分泌性ホスホリパーゼA2※3 (PLA2G5, PLA2G2E)が肥満マウスの脂肪細胞に著しく発現誘導されることを見出しました。 そこで、この2種の脂質分解酵素の肥満における発現誘導の意義を解明するために、それぞれの遺伝子欠損マウスを用いて、メタボリックシンドロームの表現型解析を行いました。
PLA2G5の欠損マウスに高脂肪食を与えると、野生型マウスと比べて肥満が増悪し、またこれにともなって内臓脂肪蓄積、脂肪肝、高脂血症、インスリン抵抗性の増悪が認められました(図1A)。 欠損マウスの内臓脂肪組織では炎症促進性のマクロファージ(M1タイプ)が増加する一方、炎症抑制性のマクロファージ(M2タイプ)は減少しており、慢性炎症のバランスが促進の方向に傾いていました。 次に、PLA2G5による炎症抑制のメカニズムをより詳しく解析するために、リピドミクス(脂質の網羅的解析)※4を行いました。 その結果、脂肪細胞から分泌されたPLA2G5は血漿中の低密度リポタンパク質※5粒子に作用し、粒子を構成するある種のリン脂質から不飽和脂肪酸(オレイン酸、リノール酸など)を遊離することがわかりました。 肥満により肥大化した脂肪細胞から大量に放出される飽和脂肪酸(パルミチン酸など)は脂肪組織の慢性炎症を引き起こし、M1マクロファージを誘導します。 PLA2G5の作用により遊離された不飽和脂肪酸は、飽和脂肪酸(パルミチン酸)によるM1マクロファージの誘導に対して拮抗的に作用し、M2マクロファージへの形質変換を促進しました。 したがって、PLA2G5はリポタンパク質粒子のリン脂質から不飽和脂肪酸を動員することで、脂肪組織の慢性炎症を抑制する役割を持つことがわかりました。 更にマウスと同様に、ヒトの内臓脂肪組織におけるPLA2G5の発現量と血漿低密度リポタンパク質の量にも有意な逆相関が認められたことから、酵素(PLA2G5)と基質(リポタンパク質)の関係はヒトにおいても成り立つことが確認されました。
免疫学的な観点から見ると、M2マクロファージはTh2免疫応答※6と関連が深く、またTh2免疫応答は肥満を抑制する方向に働くことが知られています。 そこで村上研究員らは、PLA2G5が免疫バランスの制御にどのように関わっているのか検討しました。 その結果、PLA2G5はIL-4やIL-13などのTh2免疫応答時に分泌されるサイトカインにより発現誘導され、またTh2/M2免疫応答を促進する機能を持つことが判明しました。 更に、PLA2G5は直接マクロファージのM2への分化を促進しました。 したがって、PLA2G5欠損マウスは体質的にTh2/M2免疫応答が起こりにくい動物であり、この性質がPLA2G5による肥満抑制の背景にあるものと考えられました。 またこのことは、PLA2G5欠損マウスにおいて喘息(Th2免疫応答)が改善することを示した過去の論文とも合致するものです。
一方で、もうひとつのリン脂質代謝酵素であるPLA2G2Eの欠損マウスに高脂肪食を与えると、上述のPLA2G5欠損マウスの場合とは反対に、野生型マウスに比べて肥満、脂肪肝、高脂血症になりにくいことがわかりました(図1B)。 リピドミクス解析の結果、PLA2G2Eはリポタンパク質中に存在するPLA2G5の標的リン脂質とは別の種類のリン脂質を選択的に分解していることが判明しました。 したがって、脂肪組織から分泌されるPLA2G2Eは、リポタンパク質の微量リン脂質の量を調節することで、脂肪組織や肝臓への脂質の運搬・貯蔵を促進する役割を担う肥満誘導型酵素であると結論しました。 この発見は、これまで機能が全く不明であったPLA2G2Eの生理的機能を初めて解明したものであると同時に、リポタンパク質に含まれる多様なリン脂質の「質」と「量」の変動が全身の代謝に異なる影響を及ぼすことを明確に示すものです。
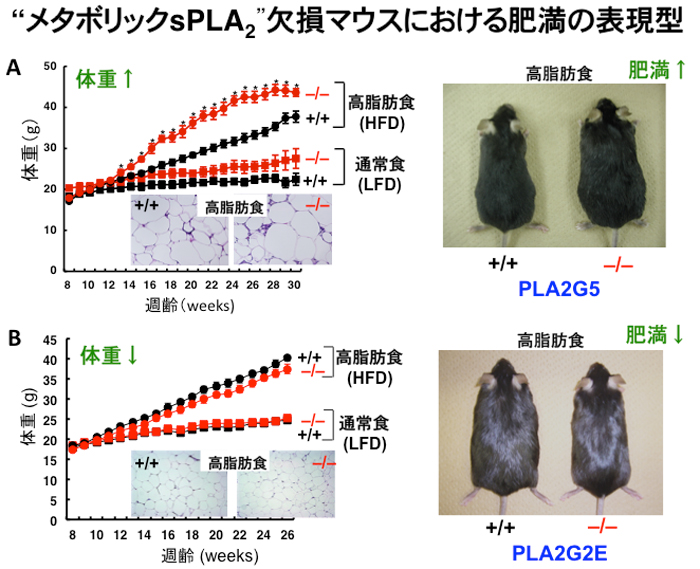
図の説明:
PLA2G5(A)およびPLA2G2E (B)の各欠損マウス(-/-)とその対照マウス(+/+)に高脂肪食(HFD)または通常食(LFD) を与えた時の体重の経過的変化、脂肪組織の組織像、およびマウスの外観。高脂肪食負荷時において、PLA2G5欠損マウスでは対照マウスと比べて体重の増加が早く、脂肪細胞が肥大化し、 肥満が増悪する(A)。一方、PLA2G2E欠損マウスでは対照マウスと比べて体重の増加がやや緩やかで、脂肪細胞が小さく、 肥満が改善する(B)。したがって、PLA2G5は肥満に対して防御的、PLA2G2Eは逆に促進的に機能するsPLA2であることが初めて明らかとなった。
これまでに分泌性ホスホリパーゼA2 は、炎症細胞から分泌され、細胞膜のリン脂質から脂質メディエーター※7を動員して炎症の増悪に関わるものと考えられてきました。 本研究は、脂肪細胞から分泌され肥満を調節する分泌性ホスホリパーゼA2 (「メタボリックsPLA2」)を同定した初めての研究成果です。 「メタボリックsPLA2」の作用は、従来の定説であった脂質メディエーターに依存した経路を介してではなく、リポタンパク質からオレイン酸などの不飽和脂肪酸を動員して脂質メディエーター非依存的に代謝性の慢性炎症を抑制する点にあります。 本発見は、本酵素ファミリーによるリポタンパク質代謝の生理的意義を初めて解明したと同時に、肥満の新しい調節機構を提示するものです(図2)。
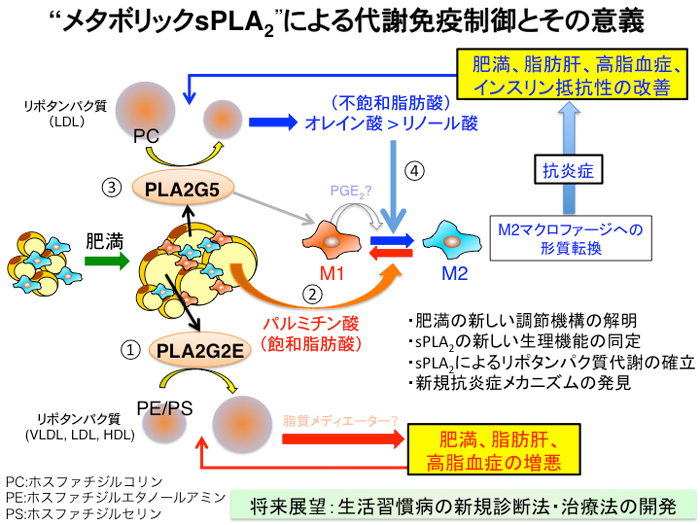
図の説明:
肥満に伴い脂肪細胞から誘導される二種類のsPLA2の作用機序。肥満により脂肪細胞が肥大化すると、①まずPLA2G2Eが分泌され、リポタンパク質中の微量リン脂質を分解することで組織への脂肪蓄積を促進する。②肥満の進行とともに脂肪細胞から遊離された飽和脂肪酸はM1マクロファージを誘導し、脂肪組織の慢性炎症を亢進する。③このシグナルに呼応して脂肪細胞からPLA2G5が分泌され、リポタンパク質の主要リン脂質を分解して不飽和脂肪酸を遊離する。④この不飽和脂肪酸は、飽和脂肪酸に拮抗的に作用してM2マクロファージを増やし、炎症応答を抑制することで、メタボリックシンドロームの進行にブレーキをかける。
【用語解説】
- ※1 インスリン抵抗性:
- インスリンの血糖値低下作用が効きにくい状態を指し、肥満や糖尿病などのメタボリックシンドロームの根本的メカニズムのひとつである。肥満に伴う慢性炎症の進行は、炎症性サイトカインの発現増加、アディポカインの分泌異常、飽和脂肪酸の増加を招く。その結果、インスリン標的臓器に脂肪毒性(過度の脂肪蓄積によるストレス応答)が生じ、インスリン抵抗性が引き起こされる。
- ※2 ホスホリパーゼA2 (PLA2)分子ファミリー:
- リン脂質を加水分解して脂肪酸を遊離する酵素の一群で、哺乳動物には30種類以上の分子種が存在し、それぞれが特有の生命応答に関わることが明らかとなってきている。
- ※3 分泌性ホスホリパーゼA2:
- ホスホリパーゼA2分子ファミリーのうち細胞外に分泌されるPLA2の一群で、sPLA2(”s”は”secreted”を示す)と総称される。哺乳動物には11種類のアイソザイム(類似の構造を持つ一群の酵素タンパク質)が存在する。本研究ではこのうち、V型sPLA2(PLA2G5)とIIE型sPLA2(PLA2G2E)を取り扱っている。
- ※4 リピドミクス解析:
- ゲノミクス(遺伝子)、プロテオミクス(タンパク質)、グライコミクス(糖)に対応する、脂質を対象とした網羅的解析を指す。それぞれの脂質分子種の分子量が異なることを利用して、組織や細胞などの検体に存在する多種多様な脂質分子種を質量分析により一斉に同定、定量する。最近の質量分析の高感度化により、微量の脂質分子種を容易に検出することが可能となった。
- ※5 低密度リポタンパク質(LDL):
- リポタンパク質は、トリグリセリド(中性脂肪)およびコレステロールを運搬する血漿中の球状粒子であり、LDLはそのひとつである。LDLは主にコレステロールを細胞に送り届ける役割を担っているが,一方でコレステロールを豊富に含むため悪玉コレステロールとも呼ばれ,血中の量が過剰になると高コレステロール血症や動脈硬化などの原因となる。本研究では、LDL中の別の脂質成分であるリン脂質の代謝に焦点を充てており、sPLA2によりLDLのリン脂質が分解されることがメタボリックシンドロームの調節に関わる事を初めて示したものである。
- ※6 Th2免疫応答:
- リンパ球の一種であるT細胞のうち、IL-4やIL-13などのサイトカインを分泌する細胞亜群(Th2細胞)が関わる免疫応答。アレルギー応答の増悪に関わる一方で、抗炎症性のM2マクロファージを誘導することにより肥満や動脈硬化に抑制的に作用する。
- ※7 脂質メディエーター:
- 生理活性脂質とも呼ばれる。脂肪酸のひとつであるアラキドン酸から特異的合成酵素により生合成されるプロスタグランジンやロイコトリエンが有名であり、一般に炎症を促進する活性を持つものと理解されている。一方で、エイコサペンタエン酸やドコサヘキサエン酸などの脂肪酸から産生される脂質メディエーターは抗炎症作用を示す。


