
2015年10月7日
国際科学雑誌「Acta Neuropathologica」オンライン版にパーキンソンプロジェクト(脳病理形態研究室)内原俊記副参事研究員らの論文が発表されました。
パーキンソン病のαシヌクレイン病変の多様な分布を説明する新たな仮説を提唱
研究の背景と経緯
パーキンソン病のαシヌクレインは脳の下部の神経細胞で凝集してレヴィー小体を形成し、細胞内を広がって、脳の上部の別の神経細胞へ伝播するとの仮説があります。こうした病的αシヌクレインを動物脳に接種すると、次第に病変が伝播する様に見えるので、パーキンソン病のモデルになる可能性も注目されています。ところが、αシヌクレイン病変のヒト脳での分布や臨床像は多様で、一方向のひろがりを前提とする上記の仮説・実験との間には齟齬があります。また、アルツハイマー病のタウ蛋白、アミロイドベータ蛋白、筋萎縮性側索硬化症のTDP43蛋白についても似たような齟齬があります。そこで、内原俊記副参事研究員は、フロリダ大学Benoit Giasson博士と共同で、変性疾患に関連するこれら4種類の蛋白質(αシヌクレイン、タウ、アミロイドベータ、TDP43)の各々についてヒト脳と動物実験を相互に比較するという試みを、国際科学雑誌「Acta Neuropathologica」に総説集として企画しました。ここに紹介するPropagation of alpha-synuclein pathology: hypotheses, discoveries, and yet unresolved questions from experimental and human brain studiesは内原研究員らが担当したαシヌクレインについての論文で、パーキンソン病やレヴィー小体型認知症を含むレヴィー小体病のαシヌクレイン病変の多様な分布を説明する新たな仮説を提唱しています。
この成果は、国際科学雑誌「Acta Neuropathologica」オンライン版に10月7日掲載されました(http://link.springer.com/article/10.1007/s00401-015-1485-1より free download可)。
研究の概要
レヴィー小体病でαシヌクレイン病変が起こりやすい神経細胞は、黒質、青斑核、自律神経などいずれも分岐の豊富な軸索を持つという特徴があります。さらに、この病変は軸索末端から細胞体へ向かって細胞内を進展する点で共通することをヒト剖検脳の解析から内原研究員らは明らかにしてきました(図1)。
図1
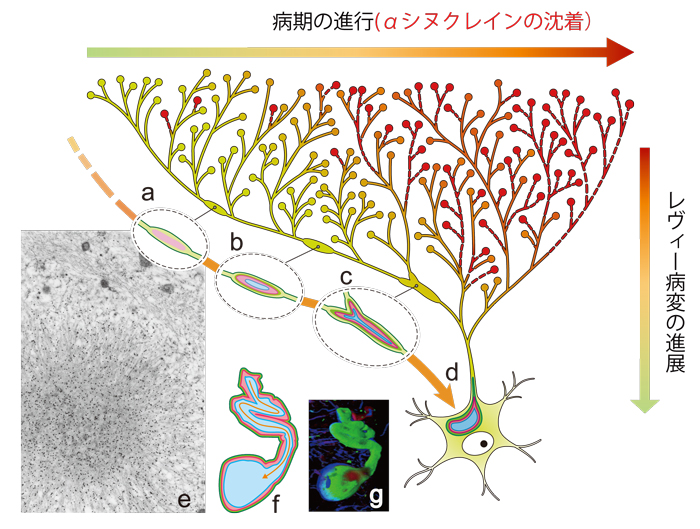
αシヌクレイン(赤色)は軸索の分岐の多い神経細胞の軸索末端から次第に沈着する。突起病変を形成しながら細胞体へ向かってa-b-cと進展し、細胞体内のレヴィー小体 (d)を形成する。レヴィー小体はαシヌクレインからなる線維の集簇で (e)、突起から連続する三層構造を持つ (三次元像 f:内部, g:外観)
(Uchihara T & Giasson B: Propagation of alpha-synuclein pathology: hypotheses, discoveries, and yet unresolved questions from experimental and human brain studies Acta Neuropathologica. http://link.springer.com/article/10.1007/s00401-015-1485-1より改変)
また、αシヌクレイン病変が初発することの多い脳の下部に病変がなくても、大脳、嗅球、自律神経、青斑核などにαシヌクレイン病変が独立して起こる場合があり、Focal Lewy body diseaseととらえることができます。こうした独立病変が、様々に組み合わさるのがレヴィー小体病で、Multifocal Lewy body diseaseととらえることを今回はじめて提唱しました(図2)。
図2
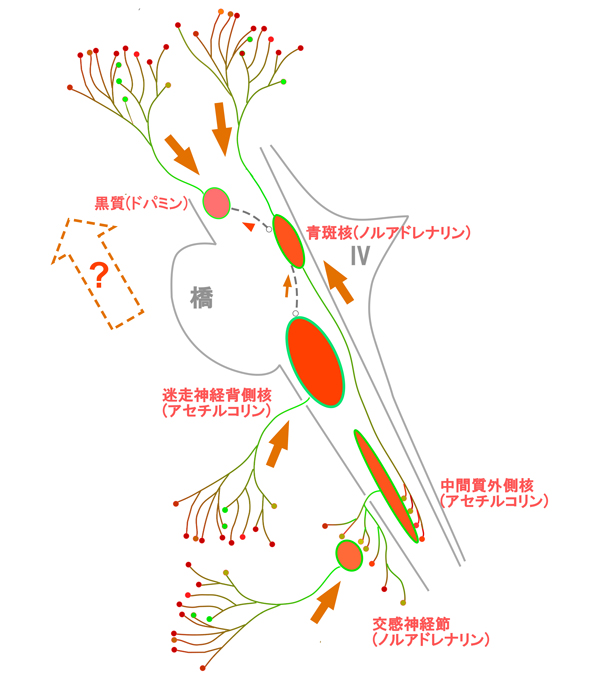
脳幹内のαシヌクレイン病変を示す。豊富に分岐した軸索末端からαシヌクレイン病変が細胞体に向かって進展することを示す(朱色矢印)。細胞間の伝搬経路 (点線)や、青斑核から上行する経路の実態はヒト脳では明らかになっておらず、病変が上行するという仮説の構造背景はヒト脳では未確定である(点線矢印)。
(Uchihara T & Giasson B: Propagation of alpha-synuclein pathology: hypotheses, discoveries, and yet unresolved questions from experimental and human brain studies Acta Neuropathologica. http://link.springer.com/article/10.1007/s00401-015-1485-1より改変)
神経細胞のαシヌクレイン病変が次の細胞へ伝播するとしても、ヒト脳での経路や仕組みについてはまだ研究の途上です(図2点線)。こうした細胞間の伝播の有無にかかわらず、Multifocal Lewy body diseaseという新たなとらえ方をすれば、αシヌクレイン病変のヒト脳での多様な分布をよく説明でき、最近注目されてきた非典型的で多様な臨床像とも無理なく合致します。
今後の展望
パーキンソン病をはじめとするレヴィー小体病では、αシヌクレイン病変がさまざまな脳内部位や自律神経で広汎かつ不規則にひろがり画一的な診断を困難にしています。一方、αシヌクレイン病変は 1)軸索分岐の豊富な細胞群におこりやすく、 2)軸索末端から病変が進展するという構造依存的な規則性を細胞内で保ちながら、3)様々な細胞群に独立して多発する(multifocal)ことを今回明らかにしました。障害部位が異なっても、早期におこる軸索末端の機能変化は、早期臨床症状や臨床検査の異常としてとらえやすく、早期診断の手がかりとなります。
また、内原研究員らがこの雑誌で編集中のタウ蛋白、アミロイドベータ蛋白、TDP43蛋白についての総説と互いに比較すれば、各々の病態の違いがより鮮明となり、診断・治療法の開発にも役立つと期待されます。
【用語説明】
- レヴィー小体:
- パーキンソン病を特徴づける神経細胞内の封入体。パーキンソン病の運動障害と関連する黒質病変を特徴づける。黒質以外にも脳幹の青斑核、迷走神経背側核、大脳皮質、扁桃核、末梢自律神経にも好発する。これらをまとめてレヴィー小体病と総称する。
- αシヌクレイン:
- 機能は不明だが、軸索末端やシナプスに多いという。レヴィー小体を電子微鏡で観察するとαシヌクレインが細い線維を形成していることがわかる(図1 e)。
- Focal Lewy body disease:
- レヴィー小体が、限局した細胞群にのみ出現している状態。その後そのまま限局しつづけるか、次第に他の細胞群へも進展してMultifocal Lewy body diseaseとなるかは明らかでない。

