
Apr. 2021 No.041
特集
Topics
開催報告
編集後記
Topics
ユビキチンで標識された損傷ミトコンドリアがオートファジーで分解される作用機序を解明
ユビキチンプロジェクトの山野晃史主席研究員、松田憲之参事研究員らは「ユビキチンで標識された損傷ミトコンドリアをオートファジー分解に導く分子機構 ~ Ubiquitin - OPTN(Optineurin) - ATG9A axis の発見~」について米国科学雑誌Journal of Cell Biologyに発表しました。
ユビキチンプロジェクト 主席研究員山野 晃史
生命の基本単位である細胞の中は、複雑な膜系構造が発達しており、多様な生命活動を維持する基盤となっています。その一つであるミトコンドリアはエネルギーの大部分を合成する、細胞に欠かすことのできない構造体です。しかし、ミトコンドリアはエネルギー合成の代償として、ある一定の割合で損傷を受け、細胞にとって害となってしまいます。通常、損傷を受けたミトコンドリアは、オートファジーによる浄化作用によって選択的に分解され、細胞はその恒常性を保っています。しかし、分解システムが何らかの原因で上手く機能しなくなると、パーキンソン病などの神経変性疾患を発症すると考えられています。神経変性疾患は加齢とともに発症するケースが多く、超高齢化社会を迎える日本において、その発症の根本的な原因を解明することは非常に重要です。
私が所属するユビキチンプロジェクトでは遺伝性パーキンソン病の原因遺伝子に注目して、損傷ミトコンドリアの分解メカニズムを研究しています。これまで、ParkinやPINK1と呼ばれる遺伝性パーキンソン病の原因遺伝子産物が損傷ミトコンドリアを特異的に検知して、「ユビキチン」と呼ばれる目印を付加することを明らかにしてきました。しかし、ユビキチン標識された損傷ミトコンドリアがオートファジーによって認識されるメカニズムには多くの謎が残されていました。
今回、我々はユビキチンとオートファジーを橋渡しするタンパク質であるOPTNに着目しました。顕微鏡でOPTNの細胞内分布を観察すると、損傷ミトコンドリアとオートファジーのコンタクトサイトに集積することがわかりました。次にOPTNがどのようにしてオートファジーを損傷ミトコンドリアへとリクルートさせているかの実態に迫りました。細胞内のタンパク質間相互作用を蛍光輝点に変換して検出できるFluoppiと呼ばれるシステムを用いて、OPTNと相互作用する因子を探索した結果、ATG9Aと呼ばれるオートファジーの活性化に必須のタンパク質を同定できました。さらにOPTNATG9Aの相互作用を特異的に阻害すると、損傷ミトコンドリアが正しく分解できないことがわかりました(図1)。これらの結果はOPTN-ATG9Aがユビキチン修飾された損傷ミトコンドリアをオートファジーへと導くデコーダーであることを示しています(図2)。
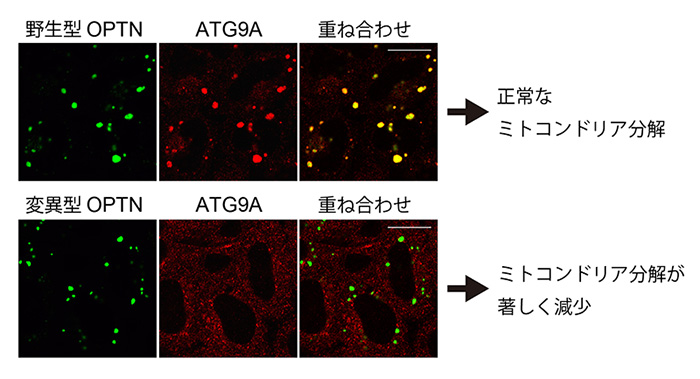
図1
Fluoppiという方法では、野生型OPTN(緑)とATG9A(赤)は共局在する(重ね合わせで黄色になる)ため、OPTNとATG9Aが相互作用していることがわかります。しかし、OPTNのある部分に変異を導入した変異型OPTNではATG9Aと共局在しなくなります。このような変異型OPTNの存在下では、損傷ミトコンドリアの分解が強く阻害されました。
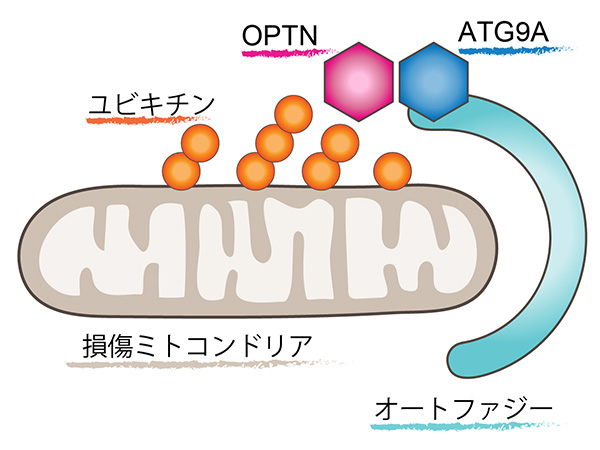
図2
本研究からユビキチンで標識された損傷ミトコンドリアはOPTNATG9Aの相互作用を介して、オートファジーで分解されることが明らかとなりました。
本研究によって、損傷ミトコンドリアの標識であるユビキチンがオートファジーシグナルとして読み出される仕組みが解明できました。今後もFluoppiなどの手法を応用し、損傷ミトコンドリア分解の理解をさらに深めていきたいと考えています。
参考文献
Yamano K, Kikuchi R, Kojima W, Hayashida R, Koyano F, Kawawaki J, Shoda T, Demizu Y, Naito M, Tanaka K, and Matsuda N.
Critical Role of Mitochondrial Ubiquitination and the OPTN-ATG9A Axis in Mitophagy
J. Cell Biol.(2020) 219: e201912144
doi: 10.1083/jcb.201912144.

