
2016年7月27日
英国科学雑誌「Nature Communications」にゲノム動態プロジェクト 正井 久雄 参事研究員、楊 其駿 研究員らの論文が発表されました。
ゲノム複製開始を制御する新たなメカニズムの発見
〜がんや疾患の新しい原因解明に期待〜
(公財)東京都医学総合研究所の正井久雄参事研究員、楊其駿研究員らは、ヒト細胞のゲノムDNA複製開始を制御する新しいメカニズムを発見しました。本研究は、進化的に保存されたタンパク質リン酸酵素Cdc7と複製制御因子Claspinの特異的相互作用による複製開始の新規制御メカニズムを明らかにしたものです。本研究成果は、ゲノムを安定的に維持・継代するための重要なメカニズムを示すとともに、がん細胞におけるゲノム複製の様式の変化がゲノム変化の原因になっている可能性を示唆するものです。
本研究は、日本学術振興会科研費(基盤研究、新学術領域研究)の一環として行われました。本研究成果は、2016年7月12日(米国東部時間午前5時)に英国科学誌『Nature Communications(ネーチャーコミュニケーションズ)』にオンライン掲載されました。
http://www.nature.com/ncomms/2016/160712/ncomms12135/full/ncomms12135.html
- <論文タイトル>
-
Claspin recruits Cdc7 kinase for initiation of DNA replication in human cells
ClaspinはCdc7キナーゼを引き寄せて、DNA複製の開始を促進する。
1.研究の背景
ゲノム複製は細胞の増殖にとって最も基本的な事象です。ヒト細胞は分裂するごとに、30億塩基対のDNAをほとんど誤りなくコピーし、全く同じゲノムDNAをもう1セット作り上げます。一方、複製の過程は6-8時間かかる長い過程ですが、その間に障害を受けて複製が止まったり、あるいはコピーの間違いを沢山起こすと、それはゲノムの変化として蓄積し、やがてがんやその他の疾患の原因となります。また、複製の開始・進行は、細胞周期と厳密に連動しており、その連動が破綻しても、ゲノムの変化が誘導されます。正常細胞においては、ゲノム変化が最小になるように、複製の過程は厳密に制御されています。一方、がん細胞では複製の制御に障害が生じることにより、ゲノムが”不安定”になる可能性が示唆されていますが、詳細は不明です。
進化的に保存されたCdc7キナーゼ(*1)は、Mcm(*2)というDNAヘリカーゼ(*3)をリン酸化し、複製開始に重要な働きをすることを、これまで私たちは明らかにしてきました。さらに、Claspinという進化的に保存されたタンパク質は複製フォーク(*4)でDNA合成をモニターするとともに、DNA複製が効率よく進行するのに必要であることが報告されていました。私たちはClaspinもCdc7の基質であることを発見し、その意義について調べてきました。その結果、Claspinは特定の領域を介してCdc7と結合し、この結合がCdc7によるMcmのリン酸化に重要であることを発見しました。
2.研究の概要
Claspinは種々の複製タンパク質と結合します。私たちはこの結合について詳細な解析を行いました。その結果C端近くにある酸性アミノ酸に富む領域(AP)がCdc7を始め種々の複製因子への結合に重要であることを見い出しました。特にCdc7はこのAPと直接結合することがわかりました。AP内のアスパラギン酸およびグルタミン酸(酸性アミノ酸)をすべてアラニンに置換したDE/A変異体は全くCdc7に結合せず、MCMやClaspin自身のリン酸化を行うことができないことを発見しました。このように、DE/AはClaspinからCdc7へと至るシグナリングを特異的に欠損します。またこの事実は、ヒト細胞においてはClaspinがCdc7によるMcmのリン酸化に重要であることを示します。
Cdc7はClaspinもリン酸化しますが、この意義は何なのでしょうか?
私たちはClaspinは分子内でAP領域はN端領域と結合し、その結果ClaspinのDNA結合やPCNA(*5)結合を阻害することを発見しました。Cdc7によるリン酸化はこの分子内相互作用を阻害し、ClaspinのDNA結合およびPCNA結合を促進します。
このようにCdc7はClaspinとの特異的相互作用を通じて、複製開始に必要なMcmのリン酸化を制御します。この制御は複製開始部位やタイミング(*6)の決定に重要な役割を担うと想像されます。Cdc7は同時にClaspinのリン酸化を介して、そのDNA結合、PCNA結合を制御し、おそらくその複製フォークでの機能あるいは複製ストレスへの応答過程も制御するものと想像されます(図)。
図 ClaspinとCdc7による複製開始の制御機構
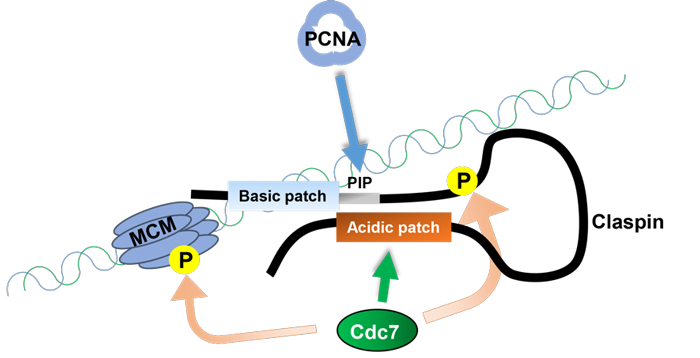
Claspin分子上の酸性アミノ酸領域(Acidic Patch; AP)は、Cdc7キナーゼを引き寄せ、これによるMcmのリン酸化を促進する。引き寄せられたCdc7はClaspinのN端側領域もリン酸化し、その結果AP領域とN端領域の分子内相互作用を抑制し、ClaspinのDNA結合およびPCNA結合も促進する。がん細胞ではCdc7-ASKの活性が増大しているためClaspinのこの機能はバイパスされると考えられる。
本研究のもうひとつの意外な発見はClaspinによるMcmリン酸化の制御は、正常細胞のみで観察され、がん細胞株では観察されなかったことです。がん細胞株ではCdc7-ASKの増産によりその活性が亢進しているのでClaspinの要求性がバイパスされているものと思われます。このようにCdc7とClaspinの相互作用およびリン酸化の促進は、正常細胞における複製開始とそれに引き続くDNA鎖伸長を連動的に制御する可能性があります。
3.今後の展望
私たちは、Cdc7-Claspin相互作用は、複製開始のみでなく、複製ストレス(*7)が引き起こす細胞応答も制御していることをすでに見い出しています。したがってClaspinによるAPを介したCdc7を始めとする複製因子の集積は、複製開始や伸長におけるレプリソーム(*8)形成と複製ストレス応答の基盤をなす可能性があります。そしてがん細胞では、このClaspinの機能はバイパスされており、これががん細胞のゲノム不安定性に貢献している可能性があります。Cdc7は、がん細胞の増殖抑制、細胞死誘導の効果的な標的であることがこれまで知られており、今後Claspin—Cdc7の相互作用を標的として新たな制がん戦略の開発なども期待されます。
用語説明
- *1 Cdc7キナーゼ:
- 複製開始に必須な役割をはたすタンパク質のセリン、スレオニンリン酸酵素。酵母からヒトまで進化的に保存される。ASKはキナーゼ活性化サブユニットでCdc7と複合体を形成するのでCdc7-ASKとも記載する。
- *2 Mcm:
- Minichromosome Maintenaceタンパク質の略。6個の構造的に類似したMcmタンパク質(Mcm2~7)が複合体を形成し、DNAヘリカーゼの活性を示す。
- *3 DNAヘリカーゼ:
- DNA複製時に二本鎖DNAを巻き戻す(開裂する)役割を果たす酵素。
- *4 複製フォーク:
- 実際にDNA複製が進行しているゲノムDNA上の領域。二本鎖が開裂しDNA合成が進行している部位をさす。
- *5 PCNA:
- Proliferating Cell Nuclear Antigenの略。DNA鋳型上でDNAを取り囲むように結合し、DNAポリメラーゼなどを結合し、鋳型DNAから解離せずに、連続的にDNA合成を進行させる役割を持つタンパク質。
- *6 複製タイミング:
- 6-8時間継続するS(DNA合成)期において、ゲノムのどの部位がいつ複製するかというルール。
- *7 複製ストレス:
- DNA複製の進行を阻害する種々の内的・外的要因。
- *8 レプリソーム:
- 複製フォークにおいてDNA複製の進行を司るタンパク質複合体。


