
2016年10月20日
東京都医学総合研究所の大竹史明主席研究員、佐伯泰副参事研究員、田中啓二所長らは、さまざまな生命現象の制御に必須なタンパク質である「ユビキチン」の新たな作用メカニズムを解明しました。研究成果は国立医薬品食品衛生研究所の菅野純元部長、兵庫医科大学の石戸聡教授との共同研究で得られたもので、2016年10月20日に米国科学誌『Molecular Cell』に掲載されました。
枝分かれした(分岐型)ユビキチン鎖が炎症応答を制御することを発見
~疾患の発症機構解明につながることを期待~
(公財)東京都医学総合研究所の田中啓二所長、佐伯泰副参事研究員、大竹史明主席研究員らは、さまざまな生命現象の制御に必須なタンパク質である「ユビキチン」の新たな作用メカニズムを解明しました。
今回の研究で初めてユビキチン鎖の分岐を定量的に測定し、分岐型ユビキチン鎖が細胞内に豊富に存在することを発見しました。この発見は、ユビキチンががんや免疫疾患など様々な疾患に関連しているため、その作用機構の理解につながり、未解明のがんや免疫疾患の発症機構解明や治療法開発に繋がることが期待されます。
研究成果は国立医薬品食品衛生研究所の菅野純元部長、兵庫医科大学の石戸聡教授との共同研究で得られたもので、2016年10月20日に米国科学誌『Molecular Cell』に掲載されました。
- <論文タイトル>
- The K48-K63 branched ubiquitin chain regulates NF-κB signaling
K48-K63分岐型ユビキチン鎖はNF-κBシグナルを制御する
1.研究の背景
タンパク質は細胞内で様々な「目印」を付加されることで、活性や機能が調節されています。ユビキチン(*1)はこうした目印の一つであり、細胞内で役割を終えた不要なタンパク質を分解するための目印になることが主な役割です。しかしユビキチンの役割はタンパク質の分解だけではなく、病原菌に対する細胞の炎症反応や、DNA損傷の修復反応を促進させるなど、様々な重要な役割を担っていることが近年急速に明らかになってきました。ユビキチンの機能に異常が生じると、がんや免疫疾患、神経変性疾患につながることがわかっています。
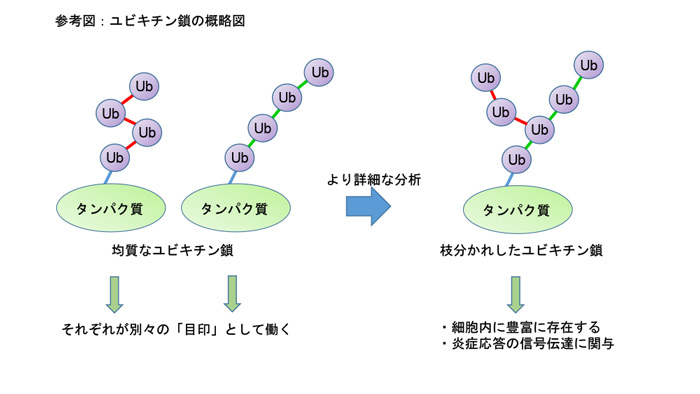
このように、ユビキチンが細胞内で非常に様々な役割を果たすことができる理由の一つとして、ユビキチンが多様な形態をとっていることが挙げられます。細胞内でタンパク質に目印として付加されたユビキチンは、さらに複数のユビキチンが鎖状につながった「ユビキチン鎖(*2)」を形成します。連結可能な位置が8か所あるため、8通りの形状のユビキチン鎖が存在し、それぞれが異なる目印として働くと考えられています。現在では、こうしたユビキチン鎖の使い分けについて数多くの研究がなされています。ユビキチン経路の阻害による疾患の治療薬開発のための基礎研究も始まっています。しかしユビキチン鎖にどれ程の複雑さがあるのか、その全貌は未だ不明です。
2.研究の概要
私たちは、質量分析技術(*3)を用いることで、ユビキチン鎖の形態を厳密かつ定量的(*4)に解析してきました。分析方法をさらに改良した結果、ユビキチンが一列の鎖状に連なるだけではなく、リジン48番とリジン63番という2か所で枝分かれした形状(分岐型)のユビキチン鎖を見出しました。このような可能性は、これまでにも主に試験管内の反応から示唆されていましたが、今回の研究では初めて定量的な測定を行い、分岐型ユビキチン鎖が細胞内に豊富に存在することを発見しました。
では、枝分かれしたユビキチン鎖にはどのような役割があるのでしょうか?私たちは免疫応答や炎症反応を制御する中心的なタンパク質であるNF-κB(*5)に着目しました。NF-κBを適切なタイミングで活性化するためには、細胞外からの炎症を伝える信号に応答してユビキチン鎖が形成され、細胞内で信号を伝える必要があります。私たちの解析の結果、枝分かれしたユビキチン鎖は枝分かれしていないユビキチン鎖に比べて、切断による不活性化を受けにくいため、より強固に信号を伝えてNF-κBを活性化することがわかりました。
3.今後の展望
今回の研究から、ユビキチン鎖はこれまで考えられていた以上に複雑な構造をとっていることがわかりました。それにより、炎症反応などの生命現象が緻密に調節されていると考えられます。ユビキチンはがんや免疫疾患など様々な疾患に関連します。したがって、ユビキチンの作用機構の包括的な理解は、将来的に、未解明の疾患の発症機構解明や治療法開発に繋がることが期待されます。
用語説明
- *1) ユビキチン
- 酵母からヒトまで共通して細胞内に存在する、小型で球状のタンパク質。他のタンパク質に目印として付加されることで、様々な役割を果たしています。ユビキチン経路の発見は2004年ノーベル化学賞の受賞対象となりました。田中所長は、ユビキチンが付加されたタンパク質を分解する酵素「プロテアソーム」の発見者であります。
- *2) ユビキチン鎖
- タンパク質に付加されたユビキチンは、単体で働くこともありますが、多くの場合、複数個が鎖状に連なったユビキチン鎖として働きます。連結可能な位置(アミノ酸残基)が8か所あるため、8通りの形状のユビキチン鎖が知られています。
- *3) 質量分析技術
- タンパク質を切断したペプチド断片や低分子化合物の質量を精密に分析することで、組成を決定する技術。タンパク質であれば、ペプチド断片のアミノ酸配列を決定し、ゲノム情報と照合することで、そのタンパク質が何であるか同定できます。
- *4) 定量的な質量分析
- 質量分析の際に、濃度のわかっている標準物質を対照とすることで、タンパク質やペプチドの存在量をfmol(フェムトモル:フェムトは1015分の1)のレベルで正確に測定できます。
- *5) NF-κB
- 免疫応答や炎症・アレルギー反応、細胞の生死など、様々な重要な生物現象を制御する転写因子。


