
2018年1月30日
大竹史明主席研究員、佐伯泰副参事研究員、田中啓二所長らは、生物にとって必須なタンパク質である「ユビキチン」が細胞内のタンパク質分解を制御する新たな作用メカニズムを解明し、米国科学誌 「Proceedings of the National Academy of Science of the United States of America (PNAS)」 に掲載されました。
枝分かれした(分岐型)ユビキチン鎖がタンパク質分解を制御することを発見
~疾患の発症機構解明につながることを期待~
(公財)東京都医学総合研究所の大竹史明主席研究員、佐伯泰副参事研究員、田中啓二所長らは、生物に必須なタンパク質である「ユビキチン」がタンパク質の分解を制御する新たな作用メカニズムを解明しました。研究成果は2018年1月30日に米国科学誌『Proceedings of the National Academy of Science of the United States of America (PNAS)』 に掲載されました。
- <論文タイトル>
- K63 ubiquitylation triggers proteasomal degradation by seeding branched ubiquitin chains
(K63ユビキチン化は分岐型ユビキチン鎖を形成することでプロテアソーム依存性タンパク質分解を促進する) - <発表雑誌>
- Proceedings of the National Academy of Science of the United States of America (PNAS)

(2018年1月30日 掲載)
1. 研究の背景
タンパク質は細胞内で常に新陳代謝を受け、新たに合成されたタンパク質と置き換わっています。このようなタンパク質分解は、異常になったタンパク質を除去することで細胞を健全に保つ役割に加え、細胞内外の状況に応じて特定のタンパク質を迅速に分解することで細胞の機能を調節する役割も有しています。
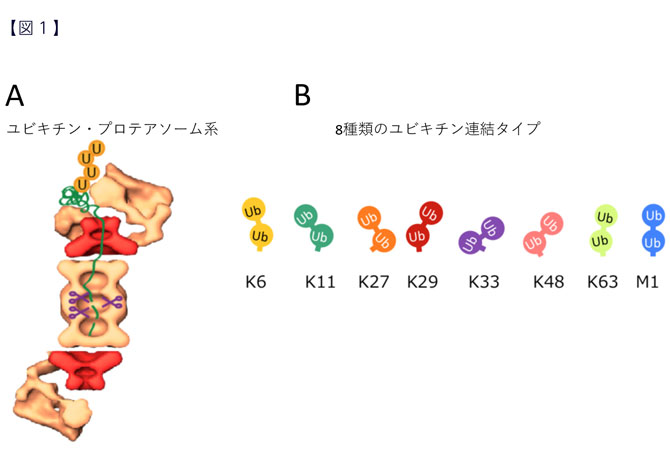
このようなタンパク質分解の多くは、ユビキチン・プロテアソーム系(*1)を介して制御されています(図1A)。ユビキチンは小型のタンパク質であり、他のタンパク質に「目印」として付加されることで、標的タンパク質の機能を様々な形で調節します。その中でも代表的な機能は、ユビキチンを付加された(ユビキチン化された)タンパク質がプロテアソームに運ばれて分解されるための目印としての機能です。ユビキチンの機能に異常が生じると、がん、免疫疾患、神経変性疾患などの病気の発症につながります。
2. 研究の概要
タンパク質に付加されたユビキチンは鎖状につながり「ユビキチン鎖(*2)」を形成します。連結可能な位置が8か所あるため、8通りの形状のユビキチン鎖が存在し、それぞれが異なる目印として働くと考えられています(図1B)。プロテアソームに運搬される目印となるユビキチン鎖については多くの研究がなされてきましたが、未だその全貌はわかっていません。
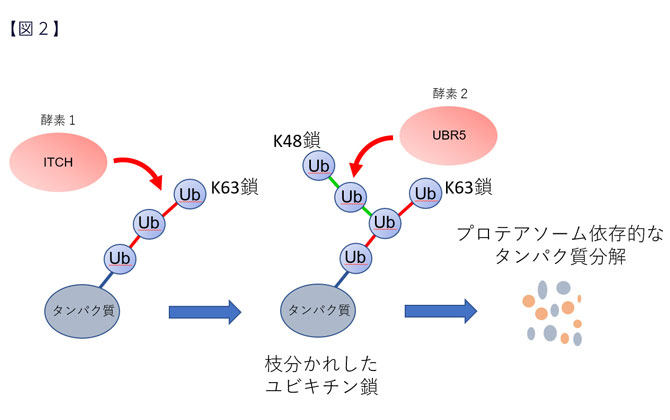
私たちはこれまでに、ユビキチンがリジン48番とリジン63番という2か所で枝分かれした形状(分岐型)のユビキチン鎖を見出し、さらなる解析を続けてきました。その結果、このタイプの分岐型ユビキチン鎖がプロテアソーム依存的なタンパク質分解に関与していることを発見しました(図2)。
さらに、このタイプの分岐型ユビキチン鎖を形成する酵素として、ITCHとUBR5という酵素を同定しました。ITCHがリジン63番で連結したユビキチン鎖、UBR5がリジン48番で連結したユビキチン鎖を形成することにより、両者が協調して分岐型ユビキチン鎖を形成することを突き止めました。
3. 今後の展望
今回の研究により、特定のタンパク質(分解の標的)がプロテアソーム依存的な分解経路へと誘導される、新たな経路が明らかになりました。また、分岐型ユビキチン鎖を付加されるタンパク質の解析から、分岐型ユビキチン鎖を介したタンパク質分解がアポトーシス(制御された細胞死)に関与している可能性が考えられます。ユビキチン・プロテアソーム系の作用機構の理解は、将来的に、未解明の疾病のメカニズム解明や治療法開発に繋がることが期待されます。
用語説明
- *1): ユビキチン・プロテアソーム系
- ユビキチンは、酵母からヒトまで共通して細胞内に存在する、小型で球状のタンパク質。ユビキチンが付加されたタンパク質は、プロテアソームに運ばれて分解されます。ユビキチン経路の発見は2004年ノーベル化学賞の受賞対象となりました。田中所長は、ユビキチンが付加されたタンパク質を分解する酵素「プロテアソーム」の発見者であります。
- *2): ユビキチン鎖
- ユビキチンには互いに連結して、鎖状に連なったユビキチン鎖として働きます。連結可能な位置(アミノ酸残基)が8か所あるため、8通りの形状のユビキチン鎖が知られています。リジン48番で連結したユビキチン鎖がプロテアソームへの目印となることが知られています(図1参照)。


