
2018年1月23日
英国科学誌 「eLife」 にユビキチンプロジェクトの山野晃史主席研究員らが 「不良ミトコンドリアを分解する新しい仕組みを解明」 について発表しました。
不良ミトコンドリアを分解する新しい仕組みを解明
【ポイント】
- 不良ミトコンドリアが適切に分解・除去されず、細胞内に蓄積するとパーキンソン病などの神経変性疾患を引き起こす
- エンドサイトーシスに関与するタンパク質がオートファジーを活性化し、不良ミトコンドリアを分解するという新しい仕組みを発見
- 遺伝性パーキンソン病発症メカニズムの解明に寄与
当研究所ユビキチンプロジェクトの山野晃史主席研究員、松田憲之副参事研究員と田中啓二所長らのグループは、米国国立衛生研究所(NIH)のRichard J. Youle博士、微生物化学研究所・構造生物学研究部の野田展生部長、京都大学ウイルス・再生医科学研究所の檜作洋平助教、国立遺伝学研究所・分子細胞工学研究部門の鐘巻将人教授、米国ハーバード大学医学大学院のWade Harper教授らとの共同研究によって、不良ミトコンドリアが分解される新しい仕組みを解明しました。本発見は細胞内のエンドサイトーシスとオートファジーという従来異なる2つとして考えられていた分解経路が互いに協調して、細胞内の浄化作用に寄与していることを示す興味深いものであると同時に、パーキンソン病などの神経変性疾患の発症メカニズムの理解に貢献する成果です。
この研究成果は、2018年1月23日に英国科学誌「eLife」にオンライン掲載されました。
- <論文タイトル>
- Endosomal Rab cycles regulate Parkin-mediated mitophagy.
- <発表雑誌>
- 英国科学誌 「eLife」 (2018年1月23日 掲載)

研究の背景
人の体は37兆個もの細胞で構成されています。生命の基本単位である細胞の中は、さらに複雑な膜系構造体が発達しており、その一つであるミトコンドリアは、生命活動に必要不可欠なエネルギーを絶えず合成している工場です。しかし、ミトコンドリアはエネルギー合成の際に発生する副産物の影響で時として不良(細胞にとって害となる)ミトコンドリアとなってしまいます。通常、不良ミトコンドリアはオートファジーに代表される浄化作用によって、選択的に分解・除去されますが、この選択的分解システムが何らかの原因でうまく働かなくなると、パーキンソン病などの神経変性疾患を発症すると考えられています。
ユビキチンプロジェクトは2010年から遺伝性パーキンソン病の遺伝子に注目して研究を開始し、「不良ミトコンドリアを適切に分解してミトコンドリア(そして細胞の)恒常性を維持することでパーキンソン病の発症を抑えていること」を明らかにしてきました。この不良ミトコンドリアの選択的分解には、2016年のノーベル生理学・医学賞の研究対象であるオートファジー(東京工業大学の大隅良典名誉教授が受賞)が深く関与しています。しかし、ダイナミックな膜動態を伴うオートファジーの分子機構は非常に複雑で、不良ミトコンドリアの選択的分解がどのような分子機序で達成されているかについては多くの謎が残されていました。
研究成果の概要
山野研究員はミトコンドリア膜上に局在するGTPaseの調節因子:Rab-GAP(具体名はFis1/TBC1D15/17複合体)に着目して研究を開始し、その標的であるRab GTPaseが適切に調整・制御されないと、オートファジー依存的な不良ミトコンドリアの分解が破綻することを見出しました。
興味深いことに、ミトコンドリア上のRab-GAPはRab7(本来はエンドサイトーシスに関与するRab GTPase)の活性を制御していることが知られていました。エンドサイトーシスは細胞外の物質を細胞内へと取り込むシステムであり、その物質の多くはリソソームへと運ばれ、分解されます。一方、細胞内の物質(不良ミトコンドリアを含む)はオートファジーによってリソソームへと運ばれ、同様に分解を受けます。
そこでミトコンドリア膜上のRab-GAPの機能が阻害された状態で、人為的に不良ミトコンドリアの分解を誘導し、Rab7タンパク質を顕微鏡で観察すると、本来はリソソームで機能するRab7がミトコンドリアへとリクルートしていることを発見しました。さらに顕微鏡観察と質量分析を用いてこの現象を詳細に解析した結果、エンドサイトーシスに関わることが知られていた一連のタンパク質がこの現象に関与することがわかりました。つまり、不良ミトコンドリアはユビキチンという分子で標識され、これがオートファジーを誘導する目印となっていますが、本研究により、1) エンドサイトーシスで機能することが知られていたユビキチン結合タンパク質RABGEF1が不良ミトコンドリアにリクルートすること(図1)、2) その結果、従来エンドサイトーシスのみで機能すると考えられていたRABGEF1→Rab5→MON1/CCZ1→Rab7のタンパク質の連携プレーがミトコンドリア膜上でも機能するようになり、オートファジーを活性化していること(図2)がわかりました。
図1:不良ミトコンドリアに局在化するRABGEF1
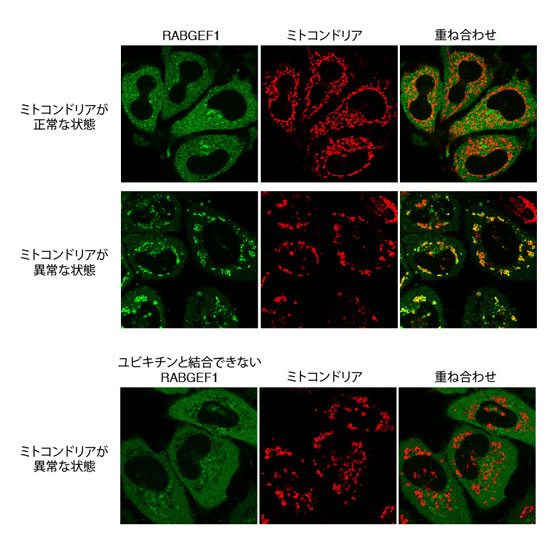
ミトコンドリアが正常な状態ではRABGEF1は細胞全体に存在していますが、ミトコンドリアが異常な状態(不良ミトコンドリア)になると、RABGEF1はミトコンドリアへと局在化します。ユビキチンと結合できないRABGEF1ではミトコンドリアが異常になっても、ミトコンドリアへと局在化できません。つまり、ミトコンドリア上のユビキチンと結合することでRABGEF1は不良ミトコンドリアへ局在化することがわかります。
図2:本研究で明らかになったオートファジー活性化の仕組み
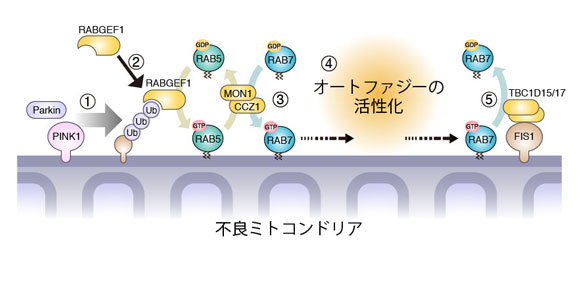
①ミトコンドリアが異常になると、ParkinとPINK1がミトコンドリア膜上にユビキチン(Ub)を付加します。②RABGEF1がミトコンドリアに局在化し、③エンドソームのRab5, MON1/CCZ1, Rab7が次々とミトコンドリアに局在化し、④オートファジーを活性化します。⑤役目を終えたRab7はミトコンドリア膜上にあるGTPase調節因子(FIS1とTBC1D15/17)によって、膜から外されます。
今後の展望
今回の研究で、不良ミトコンドリアなどの細胞内膜系構造体をリソソームへと運び、分解するための新しい仕組みと、そのプロセスに関わるタンパク質が明らかになりました。不良ミトコンドリアの選択的分解は、人の健康を考える上でも重要で、世界中でこの課題について研究がなされています。本研究の知見が本当に人の神経細胞で起きており、その破綻がパーキンソン病など神経変性疾患を引き起こすかは現在のところ不明であり、さらなる研究の展開が必要となります。
用語説明
- パーキンソン病
- 手のふるえ、動作困難・歩行困難などの運動障害を症状とする神経変性疾患。孤発性と遺伝性に大別されます。パーキンソン病患者全体の8-9割を占める孤発性パーキンソン病は、環境要因や生活習慣などの複雑な要因に影響されるために、発症の根本的原因を突き止めることが非常に困難です。一方、遺伝性パーキンソン病は単一の遺伝子異常によって発症するため、病気の発症原因を特定しやすい可能性があります。実際に、遺伝性潜性パーキンソン病の原因遺伝子産物であるParkinやPINK1は不良ミトコンドリアの分解に必須であるため、神経細胞での不良ミトコンドリアの蓄積が発症原因であると考えられています。
- ユビキチン
- 進化的に保存された小さなタンパク質。細胞の中で他のタンパク質に結合することで、分解の目印となります。ユビキチンが結合したタンパク質はプロテアソームと呼ばれる装置で分解されます。従来、ユビキチンは個々のタンパク質の運命を決定すると考えられていましたが、最近になって、ミトコンドリアのような大きな膜構造体をオートファジー経路で分解する際の目印にもなることがわかってきました。
- ミトコンドリア
- 細胞の中の膜系構造体の一つで、細胞のエネルギーを合成します。2枚の生体膜からなり、内部には核とは異なる独自のDNA(ミトコンドリアDNA)を持ちます。ミトコンドリアの機能低下や異常は、老化、肥満、神経変性疾患、癌などを引き起こすことが知られています。
- GTPase
- グアノシン三リン酸(GTPと称される)と結合し、加水分解する酵素あるいはタンパク質の総称。細胞内の膜動態や細胞骨格の調節において機能するものなど、多数存在します。特に低分子量GTPaseとして知られるタンパク質は、GTP結合状態とGTPの加水分解後の状態の違いを利用して分子スイッチとして働くことが知られています。


