
2018年2月6日
英国科学誌「Nature Communications」に蛋白質代謝研究室の土屋光研究員らが「ユビキチン鎖長測定法の開発~ユビキチン関連疾患の正確な理解につながることが期待~」について発表しました。
ユビキチン鎖の長さを決定する方法を世界で初めて開発
~ユビキチン関連疾患の正確な理解につながることが期待される~
蛋白質代謝研究室の土屋光研究員、大竹史明主席研究員、田中啓二所長、佐伯泰副参事研究員らは、東京工業大学の駒田雅之教授らと共同研究によりユビキチン鎖の長さを測定する手法を世界で初めて開発しました。本方法により、基質タンパク質に付加したユビキチン鎖の長さを明らかにするとともに、ユビキチン選択的シャペロンであるp97が細胞内のユビキチン鎖長制御に関与することを明らかにしました。本研究成果はユビキチン・プロテアソーム系が関与する疾患の発症機構解明や薬剤開発の基盤となることが期待されます。
本研究は、日本学術振興会科研費(新学術領域研究、特別推進研究)および(公財)武田科学振興財団、(公財)住友財団の研究助成により実施しました。この研究成果は、2018年2月6日に英国科学誌『Nature Communications』にオンライン掲載されました。
- <論文タイトル>
- Ub-ProT reveals global length and composition of protein ubiquitylation in cells
- <発表雑誌>
- Nature Communications (2018年2月6日 掲載)

1. 研究の背景
ユビキチンは酵母からヒトまで進化的に保存された小さなタンパク質です。ユビキチンの主な役割は、標的となるタンパク質に「目印」として付加され(ユビキチン化)、タンパク質の運命を決定することです。ユビキチン化された不要なタンパク質や異常タンパク質はプロテアソーム (*1)により認識され速やかに分解・除去されます。一方で、ユビキチンは膜タンパク質の輸送、細胞内の情報伝達、DNA損傷の修復などの目印にもなることがわかっており、多彩な機能を発揮することが近年分かってきました。ユビキチンの機能が損なわれるとがんや免疫疾患、パーキンソン病やアルツハイマー病などの神経変性疾患の発症につながることがわかっており、ユビキチン研究は基礎研究だけでなく臨床面からも注目を集めています。
ユビキチンが細胞内で様々な現象の目印となることができる理由として、ユビキチンが多様な構造をとることがあげられます。ユビキチンは多くの場合、ユビキチン同士が連結することで数珠状のユビキチン鎖を形成します。ユビキチンには連結できる場所が8か所あるため、異なる構造をもつ8種類のユビキチン鎖(K6 鎖、K11鎖、K27鎖、K29鎖、K33鎖、K48鎖、K63鎖およびM1 鎖)が存在し、それぞれが独自の目印として機能します。一方、ユビキチン鎖の長さも目印としての重要な要素の一つであり、これまで4つ以上の長さのK48鎖がプロテアソームによる基質タンパク質分解のための目印になることが試験管内の実験で示されています。しかしながら、これまで細胞内のユビキチン鎖の長さを測定する手法が存在しなかったため、細胞内ではどれくらいの長さのユビキチン鎖が基質タンパク質に付加されているのかについてほとんどわかっていませんでした。
2. 研究の概要
私たちはユビキチン鎖に対する高親和性プローブによるユビキチン鎖の保護とトリプシンによる限定分解を組み合わせることでポリユビキチン鎖の長さを決定する’Ubiquitin chain protection from trypsinization (Ub-ProT)’法を開発しました(図1)。この方法を用いて細胞内のユビキチン化基質に付加されるユビキチン鎖の長さの測定を試みました。まず、モデル生物である出芽酵母に存在するグローバルなユビキチン化基質についてユビキチン鎖長決定を試みました。その結果、細胞内の基質タンパク質には平均2~7個の長さのユビキチン鎖が付加していることが明らかとなりました。さらに、質量分析計を用いた定量的な解析をおこなったところ、ユビキチン鎖の長さにより異なる種類のユビキチン鎖が含まれることがわかりました。興味深いことに、ユビキチン鎖の長さはプロテアソームを阻害してもあまり変わりませんが、プロテアソームの上流で機能するユビキチン選択的シャペロンp97 (*2) の変異体中ではユビキチン鎖の長さが顕著に伸長することがわかりました(図2)。よって、p97がユビキチン化されたタンパク質をつかまえることにより、プロテアソームで分解しやすいようにユビキチン鎖の長さを調節していると考えられます。また、上皮成長因子の受容体EGFR (Epidermal Growth Factor Receptor) (*3)に結合するユビキチン鎖の長さを解析しました。その結果、EGFRはEGF刺激直後により4~6個のK63鎖が付加されることが明らかとなりました(図3)。
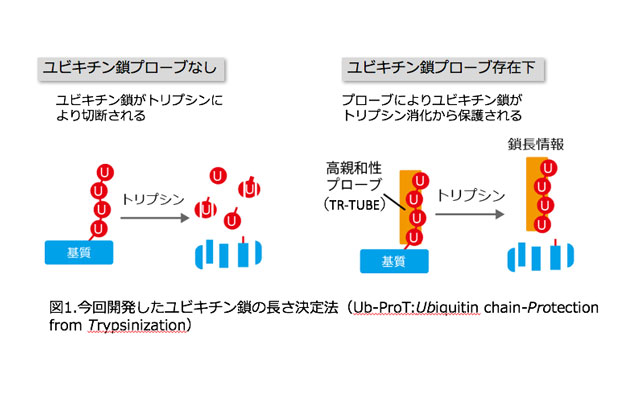
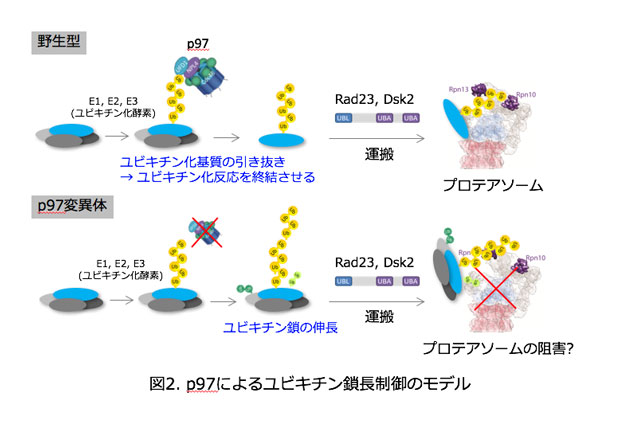
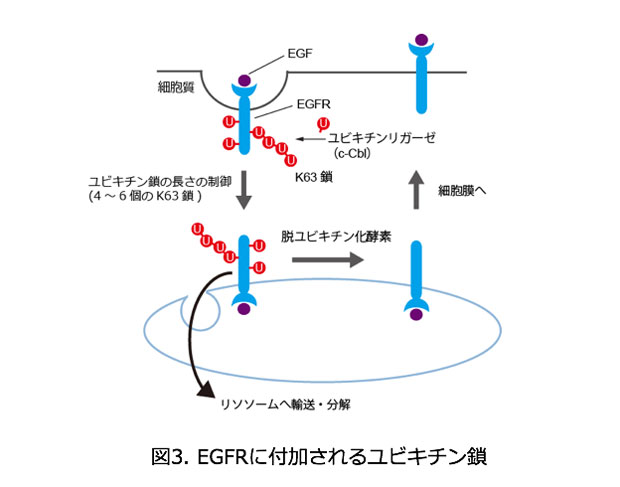
3. 今後の展望
ユビキチン・プロテアソーム系の破たんは様々ながんや神経変性疾患と密接に関わっており、創薬のターゲットとして注目を集めています。ユビキチン鎖の長さは機能に重要であることが想定されていましたが、解析手法そのものが存在しなかったため研究することができませんでした。本研究ではp97の機能が損なわれると細胞内のユビキチン鎖の長さが伸長することを見出しました。p97は家族性筋萎縮性側索硬化症 (amyotrophic lateral sclerosis: ALS)や骨パジェット病と前頭側頭型認知症を伴う遺伝性封入体筋炎 (IBMPFD)において変異が同定されており、大きく注目されております。また、EGFRの安定化は異常な細胞増殖(がん化)引き起こすと考えられており、EGFRの厳密な量的制御が重要です。この量的制御のためには、ユビキチン化EGFRのリソソームへの輸送及び分解と脱ユビキチン化酵素による細胞膜へのリサイクリングが重要であるとされていますが、今回ユビキチン鎖の長さも制御に重要であることが示唆されました。このように、今回開発したユビキチン鎖長決定法は基質タンパク質の生理的なユビキチン鎖の構造及び細胞内での制御機構を理解するために有用な方法であり、ユビキチン修飾の構造を正確に理解することは、ユビキチンが関与する様々な疾患の発症機構解明や薬剤開発の基盤となることが期待されます。
用語説明
- *1): プロテアソーム
- 細胞内の不要なタンパク質を分解する巨大な酵素複合体。ユビキチンが付加されたタンパク質を選択的に分解することにより様々な生命現象を制御している。
- *2): p97
- p97(酵母ではCdc48)はAAA+ATPaseタイプのユビキチン選択的シャペロン分子であり、小胞体関連タンパク質分解経路などのタンパク質品質管理においてプロテアソームの上流で機能することがしられている。
- *3): 上皮成長因子受容体EGFR (Epidermal Growth Factor Receptor)
- 細胞の分化、増殖、生存など様々な細胞内機能を制御するチロシンキナーゼであり、細胞膜上で増殖因子EGF刺激により活性化される。過剰なシグナルの増強を防ぐために、活性化されたEGFRはユビキチン化された後ソソームで分解されることで量的な調節を受けることがしられている。


