2023年11月21日
ゲノム動態プロジェクトの田島陽一主任研究員、正井久雄所長らは、「がん細胞と間葉系幹細胞の融合細胞はPD-L1発現を増加させ、免疫監視システムから逃避する」について Cancer Gene Therapyに発表しました。
がん細胞と間葉系幹細胞の融合細胞は
PD-L1発現を増加させ、免疫監視システムから逃避する
当研究所 ゲノム動態プロジェクトの田島陽一主任研究員、正井久雄所長らは腫瘍組織内でがん細胞と間葉系幹細胞が細胞融合を起こし、免疫チェクポイント分子のPD-L1を増加させ、免疫細胞からの攻撃を回避することを明らかにしました。本研究成果は、免疫チェックポイント阻害薬が適用できないPD-L1陰性の腫瘍を間葉系幹細胞と細胞融合させることでPD-L1陽性に変化させ、免疫チェックポイント阻害薬が効率的な腫瘍に改変できる可能性を提示しました。
この研究成果は2023年11月21日(火)(日本時間)に米国科学誌「Cancer Gene Therapy」のオンライン版に掲載されました。
- 論文タイトル:
- “Cell fusion upregulates PD-L1 expression for evasion from immunosurveillance”
(細胞融合はPD-L1発現を増加させ、免疫監視システムから逃避する) - 発表雑誌:
- Cancer Gene Therapy 2024 Jan;31(1):158-173.
DOI:10.1038/s41417-023-00693-0.
URL:https://pubmed.ncbi.nlm.nih.gov/37990063/
研究の背景
異性間骨髄移植を受けた女性がその後がんを発症し、二次性膵管腺がんの生検内で、Y染色体を含む男性由来の核が腫瘍細胞で多く検出された報告があります。このように腫瘍組織内ではがん細胞と間葉系幹細胞をはじめとする体細胞との細胞融合が多数報告されています。しかし、腫瘍組織で起きる細胞融合が、がんの性質に影響するかについては明確ではありませんでした。
研究の概要
我々は、腫瘍組織内で起きる細胞融合が、がんの特徴である腫瘍の不均一性、浸潤・転移、抗がん剤耐性などの悪性化に重要であるという仮説を立てました。腫瘍組織はがん細胞と間葉系幹細胞を含む体細胞、さらには遊走する免疫細胞より構成されています。我々は膀胱がん細胞(UMUC-3)の約5%が、間葉系幹細胞(BM-MSC)と融合し(図A)、その結果、有糸分裂異常が頻繁に起こり(図B)、ゲノム不安定性を示すことを見出しました。さらに融合細胞では免疫チックポイント分子のPD-L1が顕著に増加していました(図B)。また、融合細胞では、多くのインターフェロン刺激遺伝子(ISG)が増加していました。さらに、異種移植実験において、融合細胞は休眠期間を経て、元の膀胱がん細胞(UMUC-3)と同様に効率よく腫瘍を発生させました。人為的にPD-L1をノックアウトした(PD-L1-/-)融合細胞はPD-L1+/+の融合細胞よりも腫瘍形成が減弱することを見出しました(図C)。PD-L1-/-の腫瘍組織内ではPD-1を発現するマクロファージが多数浸潤し、がん組織の壊死が観察されましたが、PD-L1+/+の腫瘍組織内ではほとんど見られませんでした。PD-L1+/+の融合細胞はマクロファージのPD-1と結合するとマクロファージの貪食を抑制すると考えられます。一方、PD-L1-/-融合細胞はマクロファージの貪食が進行し腫瘍が退縮すると考えられます(図D)。以上をまとめると、がん細胞と間葉系幹細胞が細胞融合を起こすと融合細胞はPD-L1を増加させ、PD-1を発現するマクロファージなどの免疫細胞の攻撃を無効化することで、腫瘍形成を促進すると考えられます。また、がん細胞は体細胞と細胞融合を行うことで免疫細胞からの攻撃を保護していると考えられます(図E)。
社会的意義・今後の展望
今回の研究成果により、腫瘍組織では稀にがん細胞と体細胞の細胞融合が起き、そのことががんの悪性化につながることを示しました。がん細胞と間葉系幹細胞との相互作用については不明な点が多かったですが、細胞融合が免疫細胞の攻撃から保護し、腫瘍形成を促進させる役割を持つことが明らかになりました。臨床的には、細胞融合によりPD-L1陽性に変化している腫瘍に対しては、免疫チェックポイント阻害薬が効果的であることが予想されます。さらに、細胞融合を阻害する方法が開発できれば新たな癌治療に繋がることが期待されます。
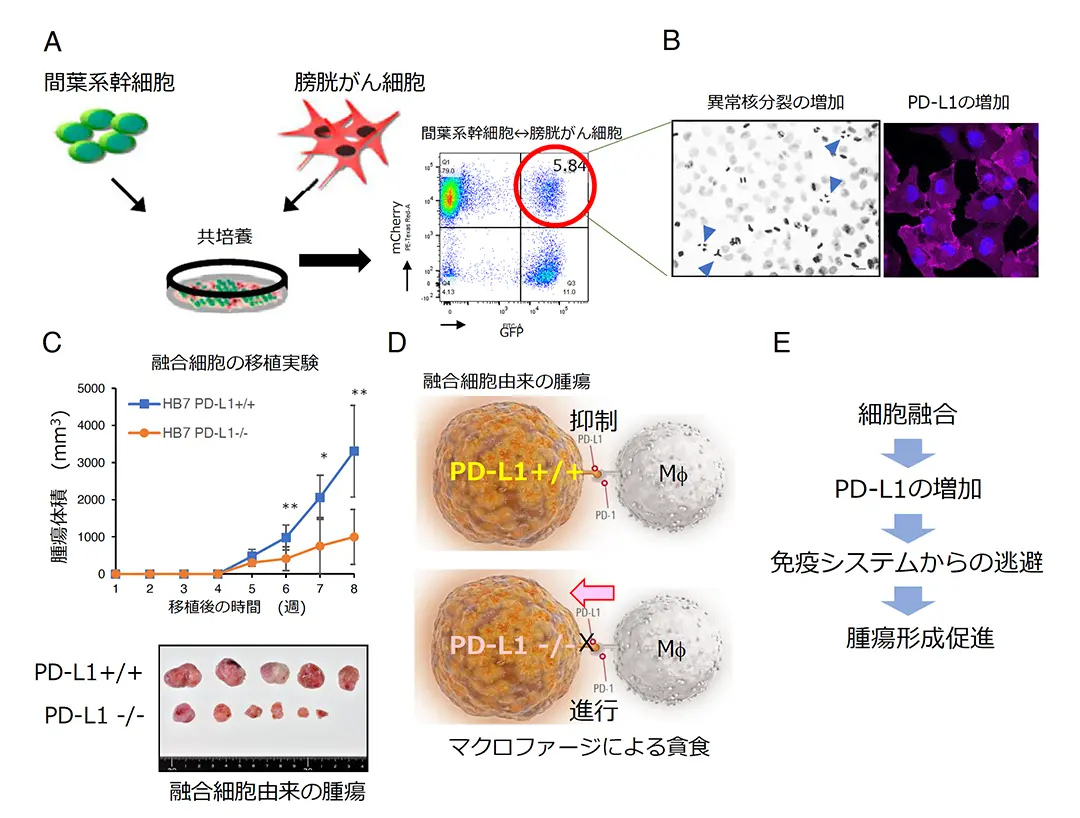
B(左)融合細胞の分裂期の染色体像。➤は3極分裂した染色体像。(右)融合細胞のanti-PD-L1抗体を用いた免疫染色。PD-L1の局在はマゼンタ(赤紫色)で示されている。
C PD-L1+/+の融合細胞とPD-L1-/-融合細胞を免疫不全マウスであるヌードマウスの皮下に移植した異種間移植実験。上:腫瘍の体積を経時的に測定。下:摘出した腫瘍
D PD-L1+/+融合細胞およびPD-L1-/-融合細胞のマクロファージによる貪食:PD-L1↔PD-1相互作用の影響。
E 今回の論文の要約。
